22岁女性,主诉“反复呕吐2个月余,肢体麻木、无力9天。”曾在外院按胃炎、自身免疫性疾病治疗,呕吐症状缓解。后来患者再次出现恶心、呕吐,伴左侧肢体麻木、无力,到笔者医院就诊,以“呕吐待查”住院治疗。该患者患有何病?如何治疗?
一、病情摘要
1.基本情况
女性患者,22岁,以“反复呕吐2个月余,肢体麻木、无力9天”为主诉,于2013年11月入院。入院前2个月余,患者无诱因出现恶心、呕吐,每天1次,频率逐渐增加,最多达10次/d,进食即吐,于外院就诊。查血常规示WBC 3.3×109/L,Hb 108g/L,PLT 148×109/L;尿常规示酮体(+);粪常规示隐血(-);血生化全套检查示白蛋白33.4g/L,低密度脂蛋白3.24mmol/L,肌酸激酶384U/L,肝、肾功能指标正常;胃镜检查示胃底隆起性病变(性质待定)、慢性胃炎;上腹部CT平扫和增强、全腹彩超、颅脑MRI平扫均未见异常;自身抗体检测示抗核抗体220AU/ml,抗SS-A抗体220AU/ml;免疫功能检查示补体C3 0.15g/L、C4 0.60g/L;肿瘤标志物正常。主治医师考虑为胃炎、自身免疫性疾病,予醋酸泼尼松(20mg/d)以及制酸、止吐、补液支持等治疗,患者呕吐症状减轻,出院。出院后,患者口服醋酸泼尼松半个月后自行停药。9天前,患者再次出现恶心、呕吐(每天5~10次),伴左侧肢体麻木、无力,左上肢抬举费力,持物不灵活,步态不稳,头晕、视物旋转感,逐渐发展为左侧颜面部及右上肢麻木,头晕、视物旋转加重,以致无法站立、行走,伴吞咽固体食物困难、饮水困难、说话音调降低,来我院就诊,以“呕吐待查”住院治疗。患者发病以来,食欲差,2个月减轻10kg。
2.既往
无特殊情况。
3.入院查体
体温36.4℃,脉搏64次/min,呼吸18次/min,血压106/79mmHg。神志清楚,体形消瘦,心、肺、腹正常。专科查体:神志清楚,言语清晰;高级神经功能正常;双眼球活动自如,各向运动到位,向左侧凝视见水平细小眼震,向上凝视见细小垂直眼震,无复视;双侧瞳孔等大,直径3mm,对光反射灵敏;左侧颜面浅触觉和针刺觉减退;双侧咽反射消失;四肢肌张力正常;右肢肌力5级,左肢肌力5-级;左侧指鼻试验欠稳准,快速轮替动作欠协调;右侧肢体共济运动正常,龙贝格征睁闭眼均不稳;左侧肢体痛触觉较右侧减退;四肢腱反射(+++);双侧霍夫曼征阳性;病理征阴性;颈稍抵抗,颏胸距2横指,凯尔尼格征、布鲁津斯基征阴性。
4.初步诊断
脑干、小脑病变待查,炎症可能。
二、诊治过程
【病例特点】
1.一般情况
患者为年轻女性,亚急性病程,以反复恶心、呕吐起病,曾误诊为胃炎。
2.治疗反应
经对症、保胃、输液治疗,呕吐症状未得到理想控制;口服小剂量激素,呕吐症状一度减轻。
3.主要临床表现
在频繁恶心、呕吐基础上,病情进展逐渐,出现眩晕、延髓麻痹、感觉障碍、共济失调等神经功能损害。
4.实验室检查
血液学检查发现抗核抗体、抗SS-A阳性,补体C3、C4水平下降。
【鉴别诊断思路】
1.定位诊断
①呕吐,病变可能定位于延髓背侧孤束核腹侧的网状结构,即呕吐中枢;②眼震,病变定位于小脑、脑干内侧纵束或小脑与脑干之间的联络纤维;③左侧面部浅感觉减退,病变定位于右侧三叉丘系或左侧三叉神经脊束;④左侧肢体感觉减退,病变定位于右侧脊髓丘脑或丘脑皮质束;⑤构音障碍、饮水呛咳,病变定位于迷走神经和舌咽神经或其核团;⑥左侧肢体共济失调,病变定位于左侧小脑半球;⑦双侧腱反射活跃,病变定位于双侧锥体束。病变综合定位于左侧小脑半球、延髓。
2.定性诊断
患者为年轻女性,以反复恶心、呕吐起病,逐渐进展为肢体无力、麻木、步态不稳、眩晕和延髓麻痹。早期颅脑MRI平扫未见明显异常,ANA、抗SS-A阳性,激素治疗一度有效,故考虑为脑干、小脑自身免疫性脑炎,需要行颅脑增强MRI检查证实。
3.鉴别诊断
(1)后循环梗死
患者为年轻女性,非卒中样急性起病,无高血压、糖尿病、心房颤动、心肌病、风湿性心脏病等卒中危险因素,且早期颅脑MRI未见急性脑梗死病灶,不支持后循环梗死诊断。
(2)多发性硬化(multiple sclerosis,MS)
患者为年轻女性,亚急性起病,临床症状、体征高度提示小脑、延髓病变,需考虑MS可能。但患者首次发病,无发病时间上多发特点(不支持MS诊断),必须通过增强颅脑MRI扫描证实病灶存在空间上多发的特点并获得新旧病灶同时存在的影像学证据,方可诊断。另外,腰椎穿刺脑脊液寡克隆区带检测有助于MS诊断。
(3)病毒性脑炎
本例患者发病前无前驱感染史,无发热等感染征象,早期颅脑MRI未显示常见类型病毒(如单纯疱疹病毒、带状疱疹病毒等)感染导致的脑炎病灶。此类脑炎多好发于额叶、颞叶、基底核等脑区,可通过颅脑MRI增强扫描确认病灶,并行相关病毒抗体检测进一步明确。
(4)脑干肿瘤
本例患者为年轻女性,亚急性起病,早期MRI增强扫描未见脑干、小脑部位占位病变,故为肿瘤的可能性小。
【诊治措施】
入院后相关检查
(1)一般检查:
血常规正常;尿酮体阳性(++);尿淀粉酶733U/L;生化全套:总胆红素17.29μmol/L,直接胆红素6.4μmol/L,总胆固醇6.58mmol/L,低密度脂蛋白4.80mmol/L;血凝全套指标正常;皮质醇分泌节律正常;心电图、胸部CT、腹部X线平片正常;腹部B超未见肝、胆、胰、脾、肾、子宫、附件等脏器病变。
(2)免疫相关检查:
血沉37mm/h;免疫球蛋白M 2.940g/L,补体C3、C4正常;自身免疫全套:抗核抗体阴性,抗可提取核抗原抗体弱阳性,抗SS-A弱阳性;甲状腺功能及相关抗体:S-TSH 1.02mIU/L,FT4 13.92pmol/L,FT3 2.13pmol/L,TPOAb 247.70IU/ml,TGAb 622.90IU/ml;抗环瓜氨酸肽抗体、抗磷脂抗体、抗中性粒细胞胞质抗体、类风湿因子、结核抗体阴性,T-SPOT阴性。
(3)腰椎穿刺脑脊液检测
压力120cmH2O(1cmH2O=0.098kPa),白细胞23×106/L,单核细胞99%,总蛋白35mg/L,糖3.6mmol/L,氯化物125mmol/L,墨汁染色阴性,寡克隆区带阳性。脑脊液涂片镜检未检出细菌、真菌、抗酸杆菌。
(4)颅脑颈椎MRI平扫+增强
延髓后部稍肿胀并信号异常,长T1长T2信号,增强扫描病灶稍有强化(图1)。
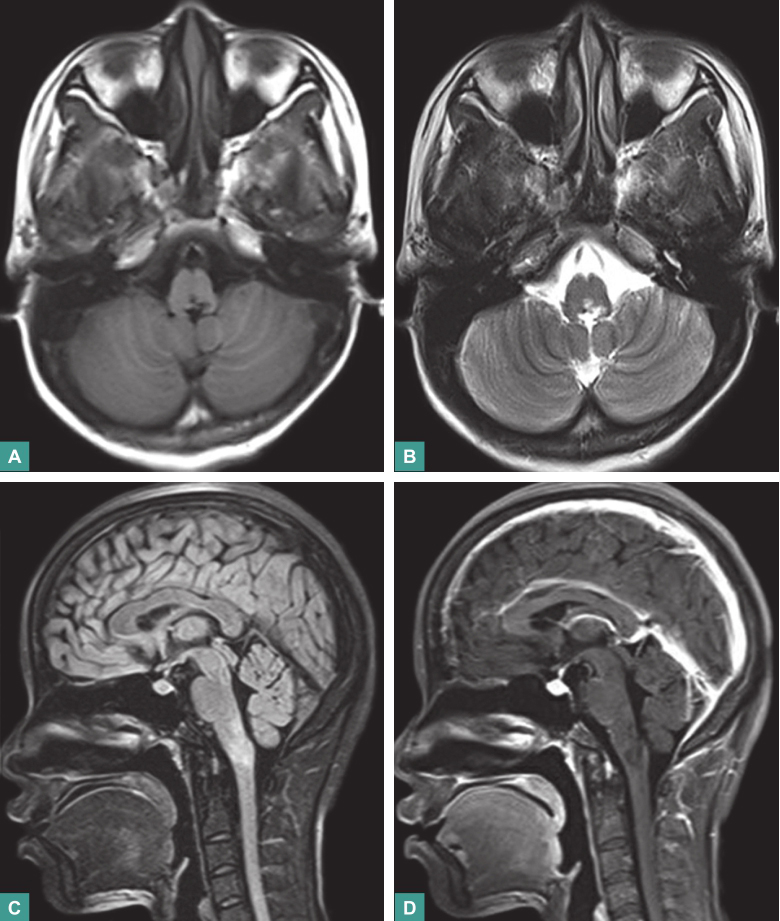
图1 颅脑颈椎MRI平扫+增强
T1WI(A)可见延髓左背侧部低信号病灶;T2WI(B)和FLAIR(C)可见病灶呈高信号;增强扫描(D)示病灶内部稍有强化
【临床难点1】
初始的反复顽固性呕吐症状是本病例定位诊断的首个难点。临床很容易将呕吐症状归属至消化系统。简单回顾本病例发病及诊治过程:患者以顽固性呕吐为主要症状起病,腹部超声、CT平扫和增强、胃镜等消化系统检查均未发现能够解释这一症状的病变,口服小剂量泼尼松,曾一度减轻呕吐症状,但停服后呕吐再度频繁出现。
呕吐是由于内脏和躯体一系列不随意运动所致,先兆症状有恶心、干呕和流涎。呕吐时,主要排出动力来自腹肌和膈肌,而胃处于相对被动状态,具体表现为胃底和胃食管括约肌松弛,腹肌和膈肌强力收缩使腹腔内压力急剧上升,幽门括约肌收缩,导致胃内容物进入食管并排出体外。呕吐亦是一种机体的反射活动,由传入神经、呕吐中枢和传出神经共同完成呕吐反射过程。呕吐中枢位于延髓孤束核腹侧的网状结构中,即延髓极后区的位置,直接接受各种传入神经的兴奋,或间接接受化学感受器触发区的刺激。传入神经刺激主要来源于咽喉、胃肠道、肝脏、胰腺、胆道、腹膜、肠系膜血管、冠状动脉、心脏、泌尿生殖系统等,通过迷走神经和交感神经的内脏传入神经,直接兴奋呕吐中枢;其次来源于中枢神经系统的刺激,包括视觉刺激、嗅觉刺激、味觉刺激、精神因素、脑炎、脑部肿瘤、脑血管病等,可直接兴奋呕吐中枢。化学感受器触发区接受外来的化学物质或药物(如阿扑吗啡、洋地黄、依米丁等)与内生代谢产物(如感染、酮中毒、尿毒症等)的刺激,并由此发出神经冲动,传至呕吐中枢再引起呕吐。传出神经包括膈神经、脊神经、迷走神经和交感神经的内脏支。因此,对于顽固性呕吐,排除常见外周组织器官病变所致呕吐后,必须考虑呕吐中枢病变(即延髓极后区病变)的可能。本例患者入院后颅脑MRI的结果证实了呕吐症状的神经系统定位。
患者为年轻女性,反复恶心、呕吐起病,并逐渐进展为肢体无力、麻木、步态不稳、眩晕和延髓麻痹,复查颅脑MRI增强扫描发现延髓炎病变稍有强化,脑脊液白细胞计数轻度增高,寡克隆区带阳性,血清寡克隆区带阴性,故考虑为自身免疫相关脑干脑炎。首次发病的单一幕下区域病灶,不符合MS诊断标准;病变特点和部位分布范围不符合常见病毒性脑炎特征;复查MRI发现延髓DWI、dADC病变特征不支持延髓梗死诊断;增强MRI进一步排除了延髓肿瘤性病变的可能。
【临床转归】
诊断自身免疫相关脑干脑炎后,经静脉滴注甲泼尼龙300mg×3天、120mg×3天、80mg×7天、60mg×7天、40mg×7天,后改为口服醋酸泼尼松40mg/d,每周递减10mg,直至停用,并予膦甲酸钠氯化钠注射液抗病毒,甘露醇、七叶皂苷钠减轻病灶水肿,甲钴胺营养神经,辅以制酸保胃、补钙、补钾、补液营养支持等治疗,患者恶心、呕吐、肢体麻木、无力、共济失调、吞咽困难、饮水呛咳症状缓解,四肢肌力5级,步态平稳。
出院1年后,患者以“渐进性双下肢麻木9天,加重并无力2天”为主诉,于2014年12月再次入院。
入院前9天,患者无诱因出现双下肢持续性麻木,伴腰背疼痛,麻木感逐渐从下向上延伸至胸部。2天前,患者肢体麻木程度加重,并出现双下肢无力,沉重感,抬腿稍无力,尚能独自行走,伴排尿无力感,于我院就诊,以“急性脊髓炎可能”住院诊治。
入院查体:
体温36.5℃,脉搏78次/min,呼吸18次/min,血压110/78mmHg。神志清楚,脑神经未见异常。四肢肌张力正常;双上肢肌力5级,双下肢肌力5-级,轻瘫试验(+);双侧指鼻试验准确,轮替试验协调,跟膝胫试验不稳。胸2平面以下痛触觉减退,深感觉正常。双上肢腱反射(++),双下肢腱反射(+++)。双侧腹壁反射消失。病理征阴性,脑膜刺激征阴性。
辅助检查:
血常规正常:血生化全套:总蛋白71g/L,总胆固醇5.40mmol/L,低密度脂蛋白3.83mmol/L,葡萄糖7.50mmol/L;肝、肾功能正常;餐后2小时血糖8.93mmol/L;心电图示窦性心律不齐;X线胸片示心肺无明显异常;C反应蛋白、类风湿因子、糖化血红蛋白、血沉正常;自身抗体:抗核抗体阳性(1∶100),颗粒型阳性,抗可提取核抗原抗体阳性,抗SS-A阳性,抗SS-B弱阳性;头颅MRI平扫+增强未见异常;颈椎、胸椎MRI平扫+增强示颈7至胸2节段脊髓肿胀并轻度强化(图2);脑干、视觉、体感诱发电位均正常;腰椎穿刺脑脊液检测:压力155mmH2O,白细胞48×106/L,单核细胞98%,多核细胞2%,糖4.33mmol/L,氯化物129mmol/L,总蛋白29mg/dl,潘迪试验阴性,墨汁染色阴性,寡克隆区带阴性。血水通道蛋白4抗体(antibody against aquaporin 4 immunoglobulin G,AQP4-IgG)阳性。
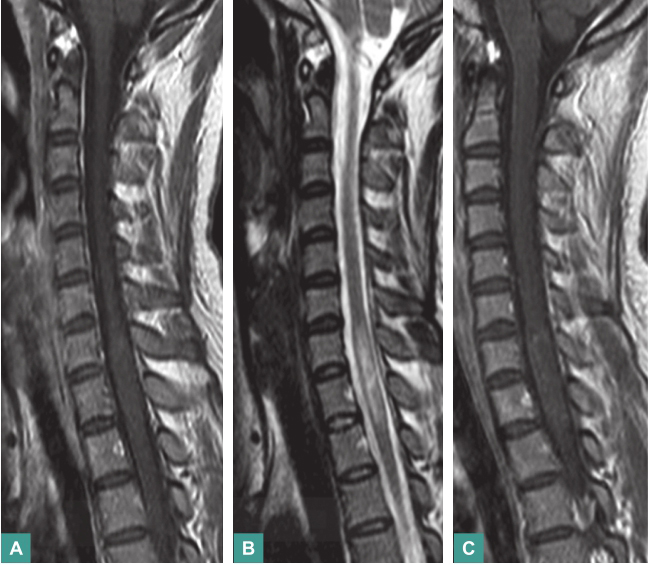
图2 颈椎胸椎MRI平扫+增强
A. T1WI可见颈7至胸2节段脊髓等信号病变并肿胀;B. T2WI可见脊髓内病灶呈高信号;C.增强扫描见病灶内部稍有强化
定位诊断:
①胸2平面以下痛触觉减退,病变定位于颈8~胸1水平;②双侧腹壁反射消失,病变定位于胸7~2水平或以上脊髓;③双下肢上运动神经元性轻瘫,病变定位于双侧胸段脊髓。综合病变定位于颈8~胸1水平脊髓。
定性诊断:
患者此次发病为亚急性起病,病情逐渐加重,表现为双下肢麻木、无力;体格检查提示颈8~胸1水平脊髓病变;MRI提示颈7~胸2节段脊髓肿胀并轻度强化,提示炎症性病灶;腰椎穿刺,白细胞数轻度增高,血AQP4-IgG阳性;1年余前曾患自身免疫相关脑干脑炎,病灶位于延髓极后区,此次发病主要累及颈胸髓,病灶超过3个脊髓节段,存在空间和时间上多发特点,符合视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)诊断标准。
最后诊断:
视神经脊髓炎谱系病。
诊断明确后,给予甲泼尼龙1g×3天、500mg×3天、250mg×3天、120mg×3天、80mg×7天、60mg×7天,后改为口服醋酸泼尼松片60mg/d,每周递减10mg直至停用,并予加巴喷丁改善肢体麻木,以及营养神经、制酸保胃、补钙、补钾等治疗;2015年1月2日起增加口服硫唑嘌呤50mg/d治疗。治疗3周后,患者双下肢肌力恢复至5级,麻木感减轻。出院3个月后,患者麻木感缓解,无排尿困难,偶有发作性双上肢、肩背部痉挛性疼痛,自行停服药物。
【临床难点2】
本例患者为年轻女性,2次临床发作均为亚急性起病。首次发病以恶心、呕吐为首发表现,逐渐出现头晕、延髓麻痹、感觉障碍、共济失调等神经功能损害表现,影像学检查提示延髓背侧炎性病灶,多项自身免疫指标阳性,予糖皮质激素治疗后病情好转,故考虑诊断为自身免疫相关的脑干脑炎。1年后再次发病,以渐进性双下肢麻木无力为首发表现,MRI显示颈7~胸2长节段横贯性脊髓炎(longitudinally extensive transverse myelitis,LETM)。综合分析2次发作时的情况,本病例具备2项NMOSD核心临床特征(极后区综合征和急性LETM),并且血清AQP4-IgG阳性,神经影像学检查也排除了脊髓肿瘤、梗死、出血等其他诊断,因此符合AQP4抗体阳性成年人NMOSD的诊断标准。
2015年神经脊髓炎(neuromyelitis optica,NMO)诊断国际专家组在NMOSD诊断标准上达成新的共识,统一命名视神经脊髓炎谱系疾病,归纳出6项临床核心症状——视神经炎、急性脊髓炎、极后区综合征(其他原因难以解释的呃逆或恶心及呕吐)、急性脑干综合征、具有NMOSD典型间脑病灶的急性间脑综合征、具有NMOSD典型大脑病灶的大脑综合征。NMOSD根据血AQP4-IgG是否阳性可进一步分为AQP4-IgG阳性、AQP4-IgG阴性及未知3类。血清AQP4抗体阳性NMOSD的诊断相对简单;而对于AQP4-IgG阴性或未知型,因存在更多诊断上的不确定性,故提出了严苛的附加条件。
成年人NMOSD诊断标准:
如果AQP4-IgG阳性,必须符合:≥1个临床核心症状并且排除其他诊断。如果AQP4-IgG阴性或未知,必须符合:①在1次或多次临床发作中,出现≥2个临床核心症状,且满足以下条件:至少1个核心临床症状是视神经炎、急性LETM或延髓极后区综合征;空间播散性(累及≥2个解剖位置);需要附加MRI的表现以支持诊断。②血清AQP4-IgG阴性或无法检测。③排除其他诊断。其中附加MRI表现包括:①急性视神经炎:需MRI具有下列表现之一:脑MRI正常或仅有非特异性白质病变;视神经长T2信号或T1增强信号>1/2视神经长度,或病变累及视交叉。②急性脊髓炎:长脊髓病变范围>3个连续椎体节段,或脊髓炎相应脊髓萎缩>3个连续椎体节段。③极后区综合征:延髓背侧病变。④急性脑干综合征:脑干室管膜周围病变。
本病例病情发展及诊治过程超过1年,期间两次临床发作,才最终确诊。患者首次临床发作表现为顽固性呕吐,很容易导致临床医师误诊,侧重考虑消化系统疾病、风湿免疫类疾病,因此很难迅速判读延髓极后区病变导致中枢性呕吐。
NMO也有结缔组织病(connective tissue disease,CTD)——中枢神经系统受累的一种表现形式。NMOSD患者血清亦可检出其他自身免疫抗体,如抗核抗体、抗SS-A/SS-B抗体、抗磷脂抗体等。约70%系统性红斑狼疮(SLE)和20%干燥综合征(SS)可以合并中枢神经系统受累,其中部分患者血清检测可见AQP4-IgG。北京协和医院的乔琳和苏丽等进行回顾性研究,发现NMO和CTD可同时出现,其中SS最常见。本病例合抗核抗体、抗可提取核抗原抗体、抗SS-A、TPOAb及TGAb等多种自身免疫抗体阳性,提示存在自身免疫性疾病易感倾向,应注意区分是原发的NMO,还是继发的视神经、脊髓损伤。国际专家组总结相关研究结果发现,AQP4-IgG阳性的NMOSD患者中,AQP4-IgG和SLE、SS或系统性硬化相关抗体常共同存在。出现中枢神经系统症状和体征的根本原因可能与NMOSD相关,而不是SLE或SS的直接并发症。目前研究认为,AQP4-IgG并非CTD患者神经系统受累的特异性标记,只是与独特的临床表型,即LETM与复发性视神经炎高度相关。
三、点睛析评
NMOSD属于中枢神经系统脱髓鞘疾病,有其特征性的发病形式、病灶分布形式和明确的诊断标准。视神经炎和/或急性LETM为常见的首发临床表现,如果以非常见发病部位和表现起病,则会给首诊医师准确、快速诊断带来较大挑战。比如本例患者,以脑干症状为首发表现,病变位于延髓极后区、导水管、第4脑室周围,由于早期缺乏视神经炎或LETM临床表现,如果漏检或无法检测AQP4-IgG,极易造成临床误诊。因此,对于自身免疫相关脑干脑炎、急性间脑综合征以及具有NMOSD典型特征性大脑病灶的大脑综合征患者,应及早行AQP4-IgG检测,以明确是否为NMOSD,有利于早期诊断和治疗。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系





 Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
