背景介绍:
近几年,全世界肥胖人群不断增加。以美国为例,2009~2010年美国国家健康与营养调查结果,体质指数(BMI)≥30 kg/m2的肥胖人群比重增长了近3倍(13.4%~36.1%)。BMI ≥40 kg/m2的极度肥胖人群比重增加了6倍(0.9%~6.6%)。美国国家健康与营养调查,肥胖人群占美国总人口的三分之一[1]。
肥胖与多种不良代谢状态和心脑血管事件有关。肥胖增加患病的风险而增加了死亡的风险[2]。目前充分的证据显示肥胖与大肠癌、乳腺癌、子宫内膜癌、肾细胞癌、膀胱癌、食管癌、胃癌、胆囊癌和胰腺癌的发病率相关。
肾细胞癌的发病率在最近十年间不断增加:全世界肾细胞癌占所有恶性肿瘤约2%~3%[3]。美国每年有65 000例新发肾癌病例,且有13 000例因肾癌死亡[4]。发达国家发病率高于发展中国家。我国肾癌发病率也在增加,据统计2009年肾癌发病率4.5/10万。男女发病比例约为1.83:1;城市地区是农村地区发病率4.31倍。发病年龄高发于50~70岁。虽然许多潜在因素被认为与肾细胞癌有关,包括吸烟,高血压和家族遗传因素,但是肾细胞癌的病因并不明确。许多研究认为体质指数(BMI)与肾细胞癌的发生有关。
肥胖与肾细胞癌发生
肾细胞癌是肾脏恶性肿瘤的最主要病理类型,占80%~90%。肾细胞癌的发生与BMI有密切的关系,仅次于子宫内膜癌和食管癌。最重要的证据来自Renehan发表的一篇meta分析。该研究归纳了BMI和肿瘤发病率的关系,并揭示超重与肾细胞癌有密切的关系[5]。40%美国和30%欧洲的肾细胞癌患者体重超标。肾细胞癌的发病率与体重增长有剂量反应关系,即BMI每增加5kg/m2,肾细胞的发生率增加20%~30%。以色列对17岁100万青少年的调查发现BMI≥23.7 kg/m2的人群日后患肾细胞癌的风险增加[6]。一项亚洲的研究纳入了101名男性和38名女性研究提出了过高和过低的BMI,肾细胞癌发病风险相关[7]。我们中心也有研究分析1108例肾癌患者单核苷酸变异(SNP)信息,结果发现肥胖相关基因ADIPOQ rs182052位点突变与肾癌患病风险相关[8]。现有的证据表明肥胖与透明细胞癌的发生关系最为密切[9],但是仅有较少的文献分析肥胖与肾癌病理亚型,分期和分级的关系,该结论有待大规模研究进一步的验证。
脂肪细胞功能失调是肥胖与肾细胞癌生成可能机制之一。失调的脂肪细胞通过释放脂肪因子调节炎症细胞释放炎症因子,调节脂代谢为肿瘤提供能量,调节血管生成因子释放参与血管新生,并且能抑制脂联素,正向调节瘦素等参与到肾癌细胞生成[10]。
肥胖与肾细胞癌预后-肥胖的矛盾性
肥胖是公认的可怕且致命疾病的元凶,例如恶性肿瘤和心血管疾病。肥胖与肾细胞癌风险的正相关性已在前文论述。然而,这些急慢性疾病或肿瘤疾病出现后,肥胖又似乎是这些疾病的保护因素。也就是说,BMI越高的患者反而有生存获益[11]。这种肥胖矛盾的现象已经被越来越多的文献证实。
这种肥胖矛盾现象最早报道于接受持续性血液透析的终末期肾病患者。研究发现BMI越高,患者的生存时间越长[12]。近些年部分研究发现心脏衰竭[13],恶性肿瘤[14]以及老年人群[15]中也存在肥胖矛盾的现象。最近有一心血管领域的研究分析了近50万没有心血管病史的急性心肌梗死病例,结果发现院内病死率与冠心病相关因素数量成反比(冠心病相关危险因素包括高血压,吸烟,脂代谢紊乱和糖尿病)[16]。该研究成果间接说明肥胖可能是某些人群发生心血管事件风险的保护因素。虽然肥胖矛盾性的生物学机制不清楚,但是临床证据比较充分,可以基本排除统计偏倚。
肥胖矛盾性同样存在于肾细胞癌,其中以Hakimi的研究最具代表性。该研究回顾性分析了2119例肾透明细胞癌患者BMI与肾癌的死亡风险的相关性[17]。研究纳入了1995年至2012年间进行了肾根治术或肾部分切除术的患者;研究结论为超重(BMI 25~30kg/m2)和肥胖(BMI≥30kg/m2)相比于正常体重的患者出现晚期肾癌的风险分别减少39%和35%。其次,肥胖和超重患者患有中低级别肾癌较多。第三,单因素分析发现BMI越高,死亡风险越低。虽然多因素分析并没有证实,但也并未出现预想中的BMI越高,肾癌死亡风险越高。另一来自韩国的学者Yuni Choi,不仅回顾性分析了本国1543例进行手术治疗的肾细胞癌患者,并纳入了14项类似的研究进行了meta分析发现了类似的结果[18]。
虽然越来越多的研究报道了肾细胞癌患者肥胖矛盾性的现象,但是其潜在的机制研究较少。Hakimi研究不仅对BMI与肾细胞患者预后进行了临床分析,还对其中126例参与者进行全基因组分析。研究发现BMI分组与代谢及脂肪酸基因相关。脂肪酸合成酶基因在肥胖肾细胞癌患者中表达下调,而在正常体重患者表达上调[17]。脂肪酸合成酶基因在多种肿瘤中被证明参与肿瘤增殖。虽然现象并未在其他肿瘤中发现,基因分析的结果可从肿瘤微环境的角度说明肥胖起到保护作用的原因可能与肥胖为肾肿瘤细胞提供了一个较为惰性的代谢环境。
此外Hakimi的研究还发现在超重与肥胖的肾癌患者中血清白蛋白较高[17],这说明肥胖和超重的肾癌患者营养状态较好。肿瘤本身可以影响宿主的营养状态,并且可以导致恶病质。恶病质可以引起骨骼肌和脂肪减少[19]。多种因素引起的恶病质是不可逆的能量储备减少,一般的营养支持治疗无效,导致功能减退,抗肿瘤治疗耐受性差及不良预后[20]。恶病质是三分之一终末期肿瘤患者死亡原因[21]。我们中心联合宁波大学第一医院和青岛大学附属医院入组了300例转移性肾细胞癌患者,研究发现营养不良在转移性肾细胞癌患者较常见;靶向治疗肾癌患者进行营养筛查可以更好地识别预后不良的患者[22]。
肥胖与人体组分
目前文献评估肥胖的方法主要包括测量体重,身高,腰围和臀围。BMI是目前最适用的人体脂肪描述方法,定义为体重(kg)与身高(m)平方之比;但是Kabath研究肥胖与癌症发病时指出加拿大人群中,只有改良公式后(体重/身高),才发现肥胖与癌症发病率有关[23]。有学者认为BMI特异性很强,但敏感性欠佳[24]。BMI无法反映体内脂肪分布。腰围与臀围的比值常用来描述人体脂肪分布,但是该指标与BMI相关性一般。例如某些体型的患者BMI较低,但是体内脂肪含量较高。此外,有学者认为人体脂肪应该区分对待,腹部脂肪不仅仅有储存能量还有很强的内分泌功能。因为它分泌多种细胞因子和激素,腹部脂肪可认为是“内分泌器官”[25]。
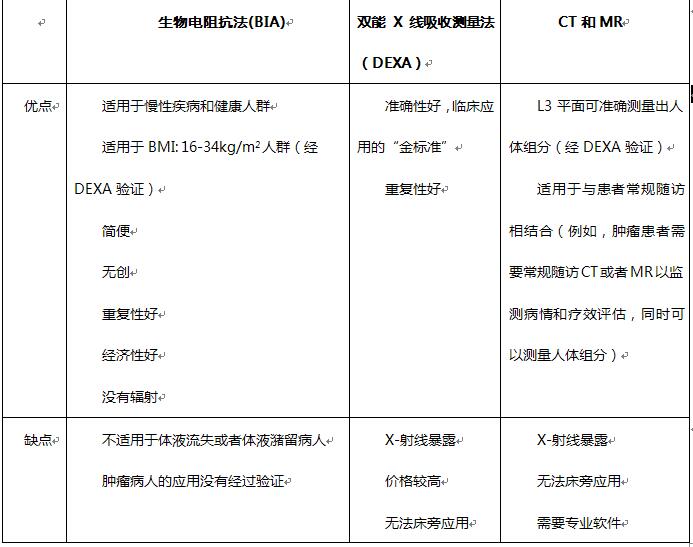
近年来越来越多的影像学技术应用于评估“肥胖”患者(表2),双能 X 线吸收测量法(DEXA),CT和MR较为常用。DEXA是一种利用身体不同组织(矿物质、瘦身体、脂肪)对X光吸收率不同的原理来测量体内脂肪含量的方法。26它是评估全身脂肪和局部脂肪(手臂,大腿和躯干)的有效方法,而且DEXA放射线暴露量十分小。CT和MR也是流行的影像学技术之一,且它是现有无创测量脂肪含量和分布的最准确的方法。该方法不仅可以测量脂肪的含量,准确区分皮下脂肪和腹部脂肪,还可测量骨骼肌肉的含量。因此,腹部CT单个层面评估人体组成为常用方法。许多软件包有人体组成分析的功能,进行脂肪,肌肉面积和体积的测量。常用的功能强大的商用软件sliceOmatic(加拿大蒙特利尔的Tomovision公司),免费软件Image J,还有根据自己研究需求进行编程的MATLAB软件。
人体组分也应用与肾细胞癌的研究,并且一定程度上揭示了肥胖矛盾性的原因。CT或者MR可以区分并量化脂肪和肌肉,而BMI不能区分脂肪和肌肉因而不能明确BMI生存获益[27]。相比于BMI,腹部脂肪在肾细胞癌患者中的预后价值不明确。一项来自日本的研究发现局限性早期肾癌患者腹部脂肪越多,死亡风险却显著降低[28]。Ladorie首次报道了腹腔脂肪在接受靶向治疗的晚期肾细胞癌患者有重要的预后价值[29]。该研究回顾性分析了64例欧洲患者,结果发现腹腔脂肪越多生存时间越短。我们在国人晚期肾癌进行了探索,研究结果发现腹部脂肪增加,死亡风险显著降低,并且提示腹部脂肪可能提示了患者营养状况[30]。有趣的是另一研究团队进行了相似的研究,回顾性分析了116例患者却得到了相反的结果[31]。此外,Antoun也做了类似的研究评估人体组成预后价值,并在模型应用了Heng评分校正[32]。该研究结果没有发现腹部脂肪有显著地预后价值,但是他们发现骨骼肌密度是独立的预后因素。不同于腹部脂肪,骨骼肌在肾细胞癌患者中的预后价值比较明确。骨骼肌减少可以反映体内蛋白质储备状况并且在晚期肿瘤中被认为是不良的预后因素,肥胖且发生骨骼肌减少的患者往往预后不良[33]。晚期肾细胞癌索拉非尼治疗的过程中会出现体重下降,脂肪和骨骼肌减少,且治疗前出现骨骼肌减少的患者往往不能耐受标准治疗而出现药物减量[34]。靶向治疗之前肾细胞癌患者出现肌肉减少往往预示不良的预后[35]。我们的研究也表明在转移性肾细胞癌患者靶向治疗的过程,早起发生肌肉减少的患者预后不佳。临床上,利用肾癌患者随访过程常规行CT或者MR检查进行人体组分的分析可以发现早期营养不良的迹象,给予患者营养支持,调整抗肿瘤治疗,建议患者加强锻炼可能改善患者预后。
结论
毫无疑问,肥胖和疾病与健康的关系并不简单。肥胖对于人类亦敌亦友;肥胖增加人群患肾细胞癌的风险,但在人类患病之时,又帮助患者抵抗疾病。肥胖矛盾性并不能代表减肥运动是毫无意义的。正如70~80年代研究发现适量饮酒有益于健康,但不能说明鼓励饮酒。肥胖是世界性的问题,且可通过调整生活方式而改变。因此探明肥胖真正的特点十分重要。
参考文献
1. Gupta PP, Fonarow GC, Horwich TB. Obesity and the Obesity Paradox in Heart Failure. The Canadian journal of cardiology. 2015;31(2):195-202.
2. Prospective Studies C, Whitlock G, Lewington S, et al. Body-mass index and cause-specific mortality in 900 000 adults: collaborative analyses of 57 prospective studies. Lancet. 2009;373(9669):1083-1096.
3. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA: a cancer journal for clinicians. 2011;61(2):69-90.
4. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA: a cancer journal for clinicians. 2012;62(1):10-29.
5. Renehan AG, Tyson M, Egger M, Heller RF, Zwahlen M. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies. Lancet. 2008;371(9612):569-578.
6. Leiba A, Kark JD, Afek A, et al. Adolescent obesity and paternal country of origin predict renal cell carcinoma: a cohort study of 1.1 million 16 to 19-year-old males. The Journal of urology. 2013;189(1):25-29.
7. Sawada N, Inoue M, Sasazuki S, et al. Body mass index and subsequent risk of kidney cancer: a prospective cohort study in Japan. Annals of epidemiology. 2010;20(6):466-472.
8. Zhang G, Gu C, Zhu Y, et al. ADIPOQ polymorphism rs182052 is associated with clear cell renal cell carcinoma. Cancer Sci. 2015;106(6):687-691.
9. Lowrance WT, Thompson RH, Yee DS, Kaag M, Donat SM, Russo P. Obesity is associated with a higher risk of clear-cell renal cell carcinoma than with other histologies. BJU Int. 2010;105(1):16-20.
10. Gati A, Kouidhi S, Marrakchi R, et al. Obesity and renal cancer: Role of adipokines in the tumor-immune system conflict. Oncoimmunology. 2014;3(1):e27810.
11. Flegal KM, Kalantar-Zadeh K. Overweight, mortality and survival. Obesity. 2013;21(9):1744-1745.
12. Kalantar-Zadeh K, Abbott KC, Salahudeen AK, Kilpatrick RD, Horwich TB. Survival advantages of obesity in dialysis patients. The American journal of clinical nutrition. 2005;81(3):543-554.
13. Kalantar-Zadeh K, Block G, Horwich T, Fonarow GC. Reverse epidemiology of conventional cardiovascular risk factors in patients with chronic heart failure. Journal of the American College of Cardiology. 2004;43(8):1439-1444.
14. Kalantar-Zadeh K, Horwich TB, Oreopoulos A, et al. Risk factor paradox in wasting diseases. Current opinion in clinical nutrition and metabolic care. 2007;10(4):433-442.
15. Oreopoulos A, Kalantar-Zadeh K, Sharma AM, Fonarow GC. The obesity paradox in the elderly: potential mechanisms and clinical implications. Clinics in geriatric medicine. 2009;25(4):643-659, viii.
16. Canto JG, Kiefe CI, Rogers WJ, et al. Number of coronary heart disease risk factors and mortality in patients with first myocardial infarction. Jama. 2011;306(19):2120-2127.
17. Hakimi AA, Furberg H, Zabor EC, et al. An epidemiologic and genomic investigation into the obesity paradox in renal cell carcinoma. Journal of the National Cancer Institute. 2013;105(24):1862-1870.
18. Choi Y, Park B, Jeong BC, et al. Body mass index and survival in patients with renal cell carcinoma: a clinical-based cohort and meta-analysis. Int J Cancer. 2013;132(3):625-634.
19. Muscaritoli M, Anker SD, Argiles J, et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: joint document elaborated by Special Interest Groups (SIG) "cachexia-anorexia in chronic wasting diseases" and "nutrition in geriatrics". Clinical nutrition. 2010;29(2):154-159.
20. Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. The Lancet. Oncology. 2011;12(5):489-495.
21. Garcia-Luna PP, Parejo Campos J, Pereira Cunill JL. [Causes and impact of hyponutrition and cachexia in the oncologic patient]. Nutricion hospitalaria. 2006;21 Suppl 3:10-16.
22. Gu W, Zhang G, Sun L, et al. Nutritional screening is strongly associated with overall survival in patients treated with targeted agents for metastatic renal cell carcinoma. J Cachexia Sarcopenia Muscle. 2015;6(3):222-230.
23. Kabat GC, Heo M, Miller AB, Rohan TE. Scaling of weight for height in relation to risk of cancer at different sites in a cohort of Canadian women. American journal of epidemiology. 2013;177(1):93-101.
24. Okorodudu DO, Jumean MF, Montori VM, et al. Diagnostic performance of body mass index to identify obesity as defined by body adiposity: a systematic review and meta-analysis. International journal of obesity. 2010;34(5):791-799.
25. Ibrahim MM. Subcutaneous and visceral adipose tissue: structural and functional differences. Obesity reviews : an official journal of the International Association for the Study of Obesity. 2010;11(1):11-18.
26. Pietrobelli A, Formica C, Wang Z, Heymsfield SB. Dual-energy X-ray absorptiometry body composition model: review of physical concepts. The American journal of physiology. 1996;271(6 Pt 1):E941-951.
27. Shirley S, Davis LL, Carlson BW. The relationship between body mass index/body composition and survival in patients with heart failure. Journal of the American Academy of Nurse Practitioners. 2008;20(6):326-332.
28. Naya Y, Zenbutsu S, Araki K, et al. Influence of visceral obesity on oncologic outcome in patients with renal cell carcinoma. Urol Int. 2010;85(1):30-36.
29. Ladoire S, Bonnetain F, Gauthier M, et al. Visceral Fat Area as a New Independent Predictive Factor of Survival in Patients with Metastatic Renal Cell Carcinoma Treated with Antiangiogenic Agents. Oncologist. 2011;16(1):71-81.
30. Gu W, Zhu Y, Wang H, et al. Prognostic value of components of body composition in patients treated with targeted therapy for advanced renal cell carcinoma: a retrospective case series. PloS one. 2015;10(2):e0118022.
31. Steffens S, Grunwald V, Ringe KI, et al. Does Obesity Influence the Prognosis of Metastatic Renal Cell Carcinoma in Patients Treated with Vascular Endothelial Growth Factor-Targeted Therapy? Oncologist. 2011;16(11):1565-1571.
32. Antoun S, Lanoy E, Iacovelli R, et al. Skeletal muscle density predicts prognosis in patients with metastatic renal cell carcinoma treated with targeted therapies. Cancer. 2013;119(18):3377-3384.
33. Gonzalez MC, Pastore CA, Orlandi SP, Heymsfield SB. Obesity paradox in cancer: new insights provided by body composition. The American journal of clinical nutrition. 2014;99(5):999-1005.
34. Antoun S, Birdsell L, Sawyer MB, Venner P, Escudier B, Baracos VE. Association of skeletal muscle wasting with treatment with sorafenib in patients with advanced renal cell carcinoma: results from a placebo-controlled study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2010;28(6):1054-1060.
35. Fukushima H, Nakanishi Y, Kataoka M, Tobisu K, Koga F. Prognostic Significance of Sarcopenia in Patients with Metastatic Renal Cell Carcinoma. J Urol. 2016;195(1):26-32.
叶定伟教授从事医教研25年,具有丰富的泌尿系统肿瘤综合治疗经验。擅长泌尿男生殖系统肿瘤早期诊断、根治手术和综合治疗,尤其擅长前列腺癌、膀胱癌和肾癌的根治性手术。1996. 9 至1998 . 12在美国MD Anderson癌症中心学习,系统掌握泌尿男性生殖系统肿瘤国际规范的手术和提高肿瘤生存率的综合治疗方法。两次入选中华医学会泌尿外科学会“将才工程”计划赴美国学习,享受国务院特殊政府津贴。担任复旦大学附属肿瘤医院副院长、泌尿外科主任,泌尿男生殖系统肿瘤多学科协作诊治中心首席专家,复旦大学泌尿外科研究所副所长,复旦大学前列腺肿瘤诊治研究中心主任,上海市泌尿外科学会副主任委员上海市抗癌协会理事长,中国抗癌协会泌尿肿瘤专业委员会候任主任委员。
相关链接:
转移性肾细胞癌一线治疗:EVE/BEV与IFN/BEV疗效相似

免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
作者:叶定伟教授,复旦大学附属肿瘤医院副院长;顾伟杰
编辑:环球医学资讯贾朝娟





 Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
