宫颈癌是女性生殖道最常见的恶性肿瘤,也是最常见的女性肿瘤死亡原因之一,极大地威胁着女性健康。随着我国宫颈癌筛查的逐渐普及,近年来多个研究结果显示,宫颈癌患者有年轻化及早期新发病例比例上升的趋势。宫颈癌的治疗强调的是综合治疗,即在治疗指南的框架下结合患者具体情况,有计划地和有序地采用手术、放疗、化疗等多种治疗手段。目前公认早期宫颈癌(ⅠA~ⅡA期)患者可行根治性手术治疗或者根治性同步放射治疗,两者治疗效果相当。根治性放疗的近远期消化系统、泌尿生殖系统副反应影响患者生活质量,且放射治疗技术及设备在我国分布不均衡,基于上述原因,目前在我国对于多数无严重内科合并症的早期宫颈癌患者,以手术为主的综合治疗仍是主要治疗方式。
对于早期宫颈癌患者术后的辅助治疗依据术后病理是否存在高中危因素而定。高危因素是指盆腔淋巴结阳性、切缘阳性和宫旁浸润,具备任何一个高危因素均推荐术后辅助放疗+顺铂同期化疗(1级证据)±阴道近距离放疗。阴道切缘阳性者,阴道近距离放疗可以增加疗效。中危因素包括淋巴脉管间隙浸润(LVSI)、宫颈间质深层浸润和原发肿瘤较大。中危因素的术后放疗指征,不同指南中推荐的标准存在差异。NCCN指南中的推荐同Sedlis标准(表1)。FIGO指南推荐的中危因素包括外1/3间质受侵、肿瘤直径≥4cm和LVSI,存在任何一个中危因素建议术后辅助放疗。而ESMO指南的中危因素定义是:肿瘤≥4cm、LVSI和宫颈间质中外1/3受累,至少满足≥两个中危因素建议术后补充放疗。
表1 Sedlis标准(根治性手术后淋巴结、切缘和宫旁阴性者辅助放疗)

2016年开始NCCN指南更新了对宫颈癌术后中危因素的注释,即中危因素的术后辅助放疗指征不应仅局限于Sedlis标准,其他因素如肿瘤病理类型、肿瘤紧邻手术切缘等也可能影响预后。在GOG 92试验延长随访时间后的结果报道显示,辅助放疗对于腺癌和腺鳞癌无进展生存率的改善较鳞癌显著,即具有中危因素的腺癌或腺鳞癌患者术后行辅助放疗有更多获益。NCCN指南中对于病理类型中含腺癌成分的患者术后接受辅助放疗的指征推荐采用“四因素模型”,即宫颈外1/3间质浸润、LVSI、肿瘤直径>3cm以及病理类型为腺癌或腺鳞癌,存在上述任何两个因素,术后辅助放疗均有益。
除上述指南中推荐的标准以外,在临床工作中还存在很多不确定的情况,如新辅助化疗后术后、不同手术分型术后辅助治疗的标准及方式,根治术后仅存在中危因素患者术后辅助放疗时是否行同步化疗、存在多个高危因素患者是否行化疗、化疗能否代替同步放化疗等现仍存在争议。本文将对上述问题进行讨论。
一、新辅助化疗后术后辅助治疗
对于FIGO分期ⅠB2和ⅡA2期宫颈癌患者,NCCN指南将盆腔外照射+顺铂为基础的同步化疗+近距离放疗作为首选推荐方案(1类证据)。但该治疗模式可引起不可逆性并发症,严重影响患者尤其是年轻患者生理健康及生活质量。而且,受限于放疗仪器普及率低、技术人员缺乏及治疗费用昂贵等,根治性手术切除目前仍是我国早期宫颈癌患者的主要治疗方案。单纯根治性手术可在一定程度上保护卵巢功能,降低因放疗带来的多种并发症,但因ⅠB2和ⅡA2期肿瘤病灶体积较大、所处盆腔位置较低,术者操作空间较为局限,且视野清晰度欠佳,极易引起医源性脏器损伤,不利于远期预后改善。既往研究认为,新辅助化疗可使局部肿瘤缩小、宫旁组织松动、盆腔充血症状改善,有利于手术操作。理论上可降低手术难度,减少手术时间、术中出血量和术后并发症。近年来,新辅助化疗联合根治性手术方案逐渐成为亚洲国家早期巨块型宫颈癌患者常用的治疗方案。
目前关于宫颈癌术后具有高中危因素进行辅助治疗的临床指南推荐是基于无术前新辅助治疗患者的研究结果,适用于初始治疗为手术的患者,指南的推荐对于新辅助治疗后联合手术的患者是否适用有待进一步研究。
既往研究普遍证明新辅助化疗能降低宫颈癌患者术后病理危险因素。李雪等研究表明新辅助化疗组淋巴脉管间隙受侵的发生率明显低于直接手术组[分别为31%(14/45)、57%(26/46),P=0.015],术后病理高危因素的发生率也明显低于直接手术组[分别为73%(33/45)、91%(42/46),P=0.024]。新辅助化疗组患者的3年DFS及OS分别为80.0%和84.4%,与直接手术组患者相比,差异无统计学意义(P>0.05)。Wen等的小样本前瞻性研究中,对比单纯手术、新辅助腔内放疗、新辅助动脉化疗及新辅助静脉联合手术治疗ⅠB2/ⅡA期患者的效果,结果表明4组的3年局部复发率及远处转移率相当。其中新辅助动脉或静脉化疗组中术后需辅助放疗的比例低于直接手术组或腔内放疗组(76.8% vs 91.7%,P=0.027)。陈悦等研究结果表明术后病理活检显示新辅助化疗可改善宫颈深层间质浸润、宫旁转移、脉管浸润情况,改善效果虽不十分显著,但可显著降低淋巴结转移率和颈管累及率。新辅助化疗组患者术后辅助化疗率降低,说明新辅助化疗有助于改善患者术后情况,两组的3年DFS和OS差异无统计学意义。既往研究普遍证明,新辅助化疗可以降低术后辅助治疗的比例,但这些新辅助化疗后患者的术后复发率仍高达30%。如何采用适当的术后辅助治疗方式以降低其术后复发风险是当前临床治疗的难点。
新辅助化疗使得无术后病理危险因素患者的比例大大升高,对这部分患者术后辅助治疗方式尚存争议。GOG 263研究是针对宫颈癌患者术后辅助治疗设计的前瞻性对照研究,但结果尚未发布。对于ⅠB2和ⅡA2期宫颈癌患者,首先已存在肿瘤直径大这一术后病理中危因素;另外,其存在其他术后病理中高危因素的发生率高,而新辅助化疗的应用可减少部分危险因素。对于接受新辅助化疗联合子宫广泛性切除术的ⅠB2和ⅡA2期宫颈癌患者,术后巩固治疗是影响其复发和死亡的重要因素。李萍萍等研究发现新辅助化疗的疗效可作为预测其预后的重要因素,新辅助化疗疗效评估分为完全缓解(CR)、部分缓解(PR)和疾病稳定(SD),该研究发现SD可增加ⅠB2和ⅡA2期宫颈癌患者的复发及死亡风险,因此,需要积极的术后辅助治疗。也有研究认为,新辅助化疗后CR的宫颈癌患者,无需接受术后辅助治疗。而对于宫颈残存肿瘤较小者,可从化疗中获益,且随着生存时间的延长,化疗的疗效可逐渐显现。
综合上述既往研究,我们认为对于宫颈癌根治术前接受过新辅助化疗的患者在选择术后辅助治疗方式时,应将新辅助化疗前肿瘤直径、新辅助化疗疗效和术后病理危险因素情况均考虑在内。对于新辅助化疗不敏感以及有多个术后病理中危因素的患者,应适当放宽术后辅助治疗的指征。尚需更多前瞻性对照研究以进一步得出明确结论。
二、不同手术分型后术后辅助治疗
对于早期宫颈癌患者术后的辅助治疗依据术后病理是否存在高中危因素而定。目前关于宫颈癌术后具有高中危因素进行辅助治疗的临床指南推荐仅适用于初始治疗为根治性手术的患者。而目前对于早期宫颈癌患者,依据不同分期及是否存在淋巴脉管间隙浸润,可实施不同的子宫切除类型,包括单纯子宫切除(A型)、次广泛性子宫切除术(B型)和保留神经的广泛性子宫切除术(C型)(表2)。同时考虑到不同地区不同手术医生技术水平的差异,术后辅助性治疗的选择对于降低患者术后复发风险显得尤为重要。
表2 宫颈癌初始治疗手术切除范围子宫切除类型
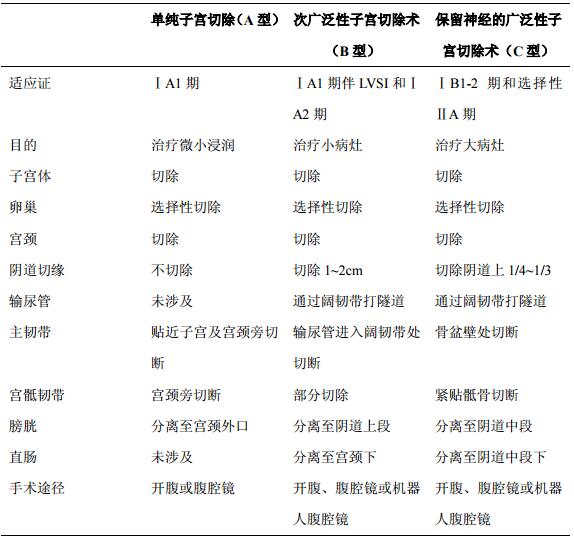
对于仅行A型子宫切除的宫颈癌患者的术后辅助治疗及处理可参照NCCN指南中意外发现的宫颈癌患者的处理。ⅠA1期无淋巴脉管间隙浸润者,可随访观察。ⅠA1期伴淋巴脉管间隙浸润或ⅠA2/ⅠB1期或切缘阳性或有病灶残留者建议完善病史、体格检查、血常规(含血小板)和肝肾功能检测及影像学检查。
(1)切缘及影像学检查均阴性者,建议行盆腔外照射+含顺铂同期化疗±个体化近距离放疗或行宫旁广泛切除加阴道上段切除+盆腔淋巴结切除±主动脉旁淋巴结取样。术后淋巴结阴性且无残余病灶者可以观察。术后淋巴或切缘或宫旁阳性者建议盆腔外照射±含顺铂的同期化疗±阴道近距离放疗。
(2)存在残留病灶、影像学检查阳性或宫旁阳性和/或切缘阳性或肿瘤特征符合Sedlis中危因素者,淋巴结阴性者建议行同期放化疗。淋巴结阳性可考虑切除淋巴结后再行同期放化疗。阴道切缘阳性者,建议行个体化近距离放疗。
对于因手术大夫水平差异无法完成根治性切除的,建议转诊上级医院或有资质的肿瘤专科医师实施根治术。对于由于术中特殊情况,比如术中广泛粘连、出血等造成的切除范围未达到根治性切除范围的,建议手术大夫应结合手术切除情况及术后病理情况决定下一步处理。
三、化疗在术后辅助治疗中的应用
关于化疗在宫颈癌根治术后的辅助治疗中的应用现还存在很多争议。宫颈癌根治术后存在高危因素患者术后补充同步放化疗已达成共识。但对仅存在中危因素患者术后辅助放疗时是否行同步化疗、存在多个高危因素患者是否行巩固化疗、化疗能否代替同步放化疗现仍存在争议。
既往研究表明辅助放疗可以改善早期宫颈癌根治术后具有中危因素患者的PFS,但对OS改善不显著,增加化疗是否能进一步改善预后是近年来研究的热点之一。一项关于宫颈癌根治术后仅存在中危因素患者是否需要同步化疗的Ⅲ期临床研究GOG 263正在进行中,结果尚未发布。目前也有一些关于术后仅存在中危因素患者行术后同步放化疗与单纯放疗疗效比较的研究。戚世芳等研究显示术后同期放化疗较术后单纯放疗降低了盆腔外复发率并提高了3年OS(92.5% vs 76.3%,P<0.05)。Peters等研究显示术后同期放化疗较术后单纯放疗提高了4年PFS(80% vs 63%,P<0.05)和OS(81% vs 71%,P<0.05)。Qin等Meta分析显示术后同期放化疗较术后单纯放疗有利于提高早期高危宫颈癌OS(HR=0.47,P=0.00)和PFS(HR=0.5,P=0.00)。亚组分析显示同期放化疗和单纯放疗对中危宫颈癌患者疗效相当。综上所述既往研究关于同步放化疗较单纯放疗是否可降低盆腔外复发率并提高生存率现仍存在争议。尚需大样本前瞻性研究证实。
早期高危宫颈癌患者术后辅助同步放化疗有较高的生存率,但仍然存在复发及远处转移风险。具有多个高危因素的宫颈癌患者约占高危因素患者的12.6%~38.4%,更易发生局部复发及远处转移,预后更差。对这部分人群的辅助治疗方案有待深入研究,以改善总体预后。术后同步放化疗后巩固性化疗能否改善这部分患者预后情况是现在研究的又一热点问题。Mabuchi等开展的Ⅱ期临床试验研究显示术后同步放化疗后巩固性化疗3年DFS和OS分别为88.5%和93.8%,均优于术后单纯同期放化疗。Zhao等开展的Ⅲ期临床试验中期分析显示术后同步放化疗后巩固性化疗的3年DFS和OS分别为82%和86.6%,均高于术后单纯同步放化疗74.3%和78.3%(P<0.05)。一项研究早期高危宫颈癌根治术后同期放化疗后巩固性化疗的疗效及安全性的临床试验正在进行(NCT00980954)。
关于宫颈癌患者术后辅助治疗中化疗能否取代同步放化疗现仍未达成共识。虽然同步放化疗在术后有危险因素的宫颈癌患者治疗中的作用已得到广泛认可,但放疗可引起放射性膀胱炎及直肠炎,甚至膀胱阴道瘘、直肠阴道瘘,同时对年轻需保留卵巢者的卵巢功能有较大影响,这些均会影响患者的生命质量。这使得化疗是否能用于宫颈癌患者的术后辅助治疗的研究成为当前研究的又一热点。因此,对于术后有危险因素的宫颈癌患者尤其是年轻患者,是否可以采用化疗作为其术后的辅助治疗值得探讨。当前对术后有危险因素的宫颈癌患者采用化疗的相关文献报道较少。Hosaka等对1991年至2002年间的50例接受根治术的ⅠB-ⅡB期宫颈癌患者进行回顾性分析,其术后危险因素为浸润间质深层、LVSI、宫旁转移、肿瘤直径>4cm,其中23例患者术后补充放疗,27例患者补充化疗,两者的3年DFS分别为82.6%和96.3%,差异无统计学意义(P=0.16)。该作者认为,对于无淋巴结转移的宫颈癌患者,化疗与放疗有同等的治疗效果。Lee等对1997年至2005年间的80例接受根治性手术的ⅠB-ⅡA期宫颈癌患者进行了回顾性分析,其术后中危因素包括浸润间质深层、脉管癌栓、肿瘤直径3~6cm、切缘距离肿瘤<1cm,其中38例患者术后补充化疗,42例患者补充放疗,随访14~73个月,两者的DFS差异无统计学意义(P=0.68)。该作者认为,术后辅助化疗可以作为术后有中危因素的ⅠB-ⅡA期患者的辅助治疗选择。Takeshima等对1993年至2002年间的65例接受根治术后的ⅠB-ⅡA期宫颈癌患者进行了回顾性分析,其中30例患者术后有中危因素(为浸润间质深层)、35例患者术后有高危因素(为切缘阳性、宫旁转移、淋巴结转移),这65例患者术后均化疗(分别为3、5个疗程),其5年DFS分别为93.3%和85.7%,局部复发率分别为3.3%和8.6%。该作者认为,宫颈癌患者术后可以采用化疗作为辅助治疗手段。温宏武等研究中,共纳入137例ⅠB-ⅡA期宫颈癌术后有危险因素并进行辅助治疗的患者,79例行化疗(化疗组),58例行放疗或放化疗(放化疗组),其5年生存率分别为88.6%和89.7%,两组比较差异无统计学意义(P=0.455)。李萍萍等研究发现,对于有多个术后病理中危因素的宫颈癌患者,术后辅助化疗及同步放化疗者较单纯放疗者的5年RFS明显升高。因此,对于这部分患者,可考虑选择术后辅助化疗或同步放化疗以预防复发。综上所述,对ⅠB-ⅡA期宫颈癌有术后危险因素的患者,尤其仅有中危因素患者,仅行化疗而不行放疗或放化疗联合也是值得考虑的辅助治疗选择,特别年轻需保留卵巢功能者。但尚需进行多中心大样本量的前瞻性研究以进一步得出明确结论。一项对比早期宫颈癌术后同步放化疗与术后单纯化疗疗效及安全性的前瞻性多中心随机对照临床试验正在进行(NCT01755897)。
综上所述,对于早期宫颈癌患者术后辅助治疗,初始治疗为根治术的患者依据术后病理是否存在高中危因素,结合国际指南进行相应的处理。而对于临床上存在的特殊仍未达成共识的情况,对于新辅助化疗后术后患者,本人认为应将新辅助化疗前肿瘤直径、新辅助化疗疗效和术后病理危险因素情况均考虑在内。对于新辅助化疗不敏感以及有多个术后病理中危因素的患者,应适当放宽术后辅助治疗的指征。对于行A型子宫切除的患者,依据术后病理可参照NCCN指南中意外发现宫颈癌的处理方法进行相应处理,而对于行B型子宫切除的患者,术前应做好评估,把握好适应证。提高手术技能,尽可能避免对本该行C型子宫切除的患者切除范围不足。关于化疗,对于根治术后仅存在中危因素的患者同步放化疗与仅放疗相比,大多数研究表明同步放化疗可降低盆腔外复发率并提高生存率。对于存在多个高危因素的患者术后辅助同步放化疗后补充巩固化疗可能对患者生存有益。对于术后病理存在危险因素的患者大多数研究表明术后辅助化疗或同步放化疗疗效相当,特别对于仅存在中危因素、年轻保留卵巢的患者化疗可能为更合适的一种补充治疗的方法,但尚需大样本前瞻性研究进一步证实。
作者:张凤 黄曼妮
来源:人民卫生出版社《临床知识》约稿
参考文献
[1] Mohar A,Frias M. Epidemiology of cervical cancer. Cancer invest,2000,18:584-590.
[2] 程静新,姚立丽,李贺月等. 5766例宫颈癌临床特征分析[J].实用妇产科杂志,2014,30(10):768-772.
[3] 章静菲,王彤,武明辉,等.北京市1399例宫颈癌的流行现状及临床特点[J].中华医学杂志,2011,91(43):3058-3061.
[4] Kon WJ,Greer BE,Abu-Rustum NR,et al. Cervical Cancer,Version 2.2015[J]. J Natl Compr Canc Netw,2015,13(4):395-404
[5] Levenback C,Eifel PJ. Cancer of the Female Lower Genital Tract[M]. Hamilton,Ont:B C Dekker,2011.
[6] Rotman M,Sedlis A,Piedmonte MR,et al. A phase Ⅲ randomized trial of postoperative pelvic irradiation in Stage IB cervical carcinoma with poor prognostic features:follow-up of a gynecologic oncology group study[J]. Int J Radiat Oncol Biol Phys,2006,65(1):169-176.
[7] 鞠丽丽,张荣,季莹,等.同步放化疗治疗局部晚期宫颈癌的效果及安全性[J].江苏医药,2016,42(20):2254-2256.
[8] He L,Wu L,Su G,et al. The efficacy of neoadjuvant chemotherapy in different histological types of cervical cancer[J]. Gynecol Oncol,2014,134(2):419-425.
[9] Cho YH,Kim DY,Kim JH,et al. Comparative study of neoadjuvant chemotherapy before radical hysterectomy and radical surgery alone in stage ⅠB2-ⅡA bulky cervical cancer[J]. Gynecol Oncol,2009,20(1):22-27.
[10] 李雪,孔为民,韩超,等. Ⅰb2和Ⅱa2期子宫颈癌患者以手术为主的不同治疗方案的前瞻性随机对照研究[J].中华妇产科杂志,2016,51(7):524-529.
[11] Wen HJ,Wu X,Li Z,et a1. A prospective randomized controlled study on multiple neoadjuvant treatments fur patients with stage ⅠB2 to ⅡA cervical cancer[J]. Int J Gynecol Cancer,2012,22(2):296-302.
[12] 陈悦,肖苏,潘伟,等.术前新辅助化疗在宫颈癌行手术治疗患者中的应用[J].国际肿瘤学杂志,2017,44(10):749-753.
[13] The Cancer Trials Support Unit databases[DB/OL]. [2018-02-15]. http//www.ctsu.org/public/data/protocols/GOG/GOG-0263/pfs.pdf.
[14] 李萍萍,李斌,王亚婷,等.新辅助化疗对Ⅰb2和Ⅱa2期术后无病理高危因素的子宫颈癌患者预后的影响[J].中华妇产科杂志,2018,53(4):248-256.
[15] Landoni F,Sartori E,Maggino T,et al. Is there a role for postoperative treatment in patients with stage Ⅰb2-Ⅱb ervical cancer treated with neo-adjuvant chemotherapy and radical surgery? An Italian multicenter retrospective study[J]. Gynecol Oncol,2014,132(3):611-617.
[16] Wang H,Zhu L,Lu W,et al. Clinicopathological risk factors for recurrence after neoadjuvant chemotherapy and radical hysterectomy in cervical cancer[J]. World J Surg Oncol,2013,11:301.
[17] 戚世芳,刘华,田晓予.早期高危宫颈癌术后同步放化疗的临床研究[J].中国实用医药,2010(34):5-6.
[18] Perers WA 3rd,Liu PY,Barrett RJ 2nd,et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix[J]. J Clin oncol,2000,18(8):1606-1613.
[19] Qin AQ,Linang ZG,Ye JX,et al. Significant efficacy of additional concurrent chemotherapy with radiotherapy for postoperative cervical cancer with risk factors:asystematic review and meta analysis. [J]. Asian Pac J Cancer Prev,2016,17(8):3945-3951.
[20] Matsuo K,Mabuchi S,Okazawa M,et al. Clinical implication of surgically treated early-stage cervical cancer with multiple high-risk factors[J]. J Gynecol Oncol,2015,26(1):3-11.
[21] Matsuo K,Mabuchi S,Fau-Okazaw AM,et al. Utility of risk-weighted surgical-pathological factors in early-stage cervical cancer[J]. Br J Cancer,2013,108(6):1348-1357.
[22] Mabuchi S,Isohashi F,Yokoi T,et al. A phase Ⅱ study of postoperative concurrent carboplatin and paclitaxel combined with intensity-modulated pelvic radiotherapy followed by consolidation Chemotherapy in surgically treated cervical cancer patients with positive pelvic lymph nodes[J]. Gynecol oncol,2016,141(2):240-246.
[23] Zhao H,Li L,Su H,et al. Concurrent paclitaxel/cisplatin chemoradiotherapy with or without consolidation chemotherapy in high-risk early-stage cervical cancer patients following radical hysterectomy:preliminary results of a phase Ⅲ randomized study. Oncotarget,2016,7(43):70969-70978.
[24] Hosaka M,Watari H,Takeda M,et a1. Treatment of cervical cancer with adjuvant chemotherapy versus adjuvant radiotherapy after radical hysterectomy and systematic lymphadenectomy. J Obstet Gynaecol Res,2008,34:552-556.
[25] Lee KB,Lee JM,Ki KD,et a1. Comparison of adjuvant chemotherapy and radiation in patients with intermediate risk factors after radical surgery in FIGO stageⅠB-ⅡA cervical cancer. Int J Gynecol Cancer. 2008,18:1027.1031.
[26] Takeshima N,Umayahara K,Fujiwara K,et a1. Treatment results of adjuvant chemotherapy after radical hysterectomy for intermediate-and high-risk stageⅠB--ⅡA cervical cancer. Gynecol Oncol,2006,103:618-622.
[27] 温宏武,黄卫平,廖秦平,等.不同辅助治疗方法对Ⅰb-Ⅱa期子宫颈癌术后有危险因素患者预后的影响[J].中华妇产科杂志,2013,42(12):920-924.
主任医师,中国医学科学院肿瘤医院妇科,主要从事中晚期宫颈癌常规放疗,复发性妇科肿瘤的常规放疗、三维适形放疗、调强适形放疗与化疗;擅长宫颈癌前病变的诊断与治疗,如阴道镜检查、高频电刀宫颈环状切除术等;为中美协助课题“宫颈癌筛查方法的比较研究”主要成员之一。
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback






 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.