26岁女性,反复发热伴皮肤丘疹、结节、溃疡、化脓10年,再发6天。期间抗生素治疗有一定疗效,解热镇痛药可短暂退热,需糖皮质激素和免疫抑制剂维持治疗。多次反复均发生在糖皮质激素减量或停药过程中。该患者怎么了?如何诊治?
一、病史简介
(一)一般资料
女性,26岁,湖南祁阳人,2016年8月15日入院。
(二)主诉
反复发热伴皮肤丘疹、结节、溃疡、化脓10年,再发6天。
(三)现病史
患者于2006年起无明显诱因反复出现发热伴皮肤丘疹、结节、溃疡、化脓,先后5次入住皮肤科、风湿科、烧伤科(因右下肢溃疡迁延不愈行扩创封闭式持续负压引流术)住院诊治,住院期间溃疡脓液培养出金黄色葡萄球菌和缓症链球菌,皮肤活检示表皮坏死,真皮及皮下脂肪血管周围致密淋巴细胞、组织细胞、少许嗜酸性粒细胞浸润,个别中小血管内皮细胞肿胀,管壁纤维素样变性,诊断为“变应性血管炎”。每次予抗生素、糖皮质激素、环磷酰胺、沙利度胺治疗,体温可恢复正常,皮损痊愈,出院后均予泼尼松继续维持治疗。2011年因贫血、粒细胞减少,脾大,多发浅表淋巴结肿大,被血液科诊断为“溶血性贫血、血红蛋白H病”,予泼尼松治疗。此次于入院前6天再次复发,当时口服泼尼松15mg/d维持治疗。
(四)既往史和个人史
否认结核等传染病及密切接触史,否认食物药物过敏史,否认毒物接触史。
(五)月经史
停经28周3天。
(六)家族史
无。
二、入院检查
(一)体格检查
1.体温40℃,心率124次/min,呼吸25次/min,血压104/60mmHg。
2.皮肤黏膜色泽正常,无焦痂,四肢可见散在分布的红色斑丘疹,有融合,疹间皮肤正常,左足面可见点状溃疡,直径2mm,表面无脓性分泌物,溃疡周围皮肤发红,有触痛,四肢可见较多圆形凹陷性瘢痕,部分有色素沉着,右下肢近踝关节可见长约5cm瘢痕(图1)。
3.神志清楚,颈部可扪及数个黄豆大小淋巴结,质软,无触痛,咽不红,扁桃体不大。
4.双肺呼吸音粗,无啰音。心率124~146次/min,律齐,无杂音。腹部较实际孕周偏小,无压痛反跳痛,肝脾扪及欠满意。
5.指/趾甲真菌感染(图1)。
6.颈软,克氏征(-)、布氏征(-)、双侧巴氏征(-)。
7.肛门外生殖器正常。
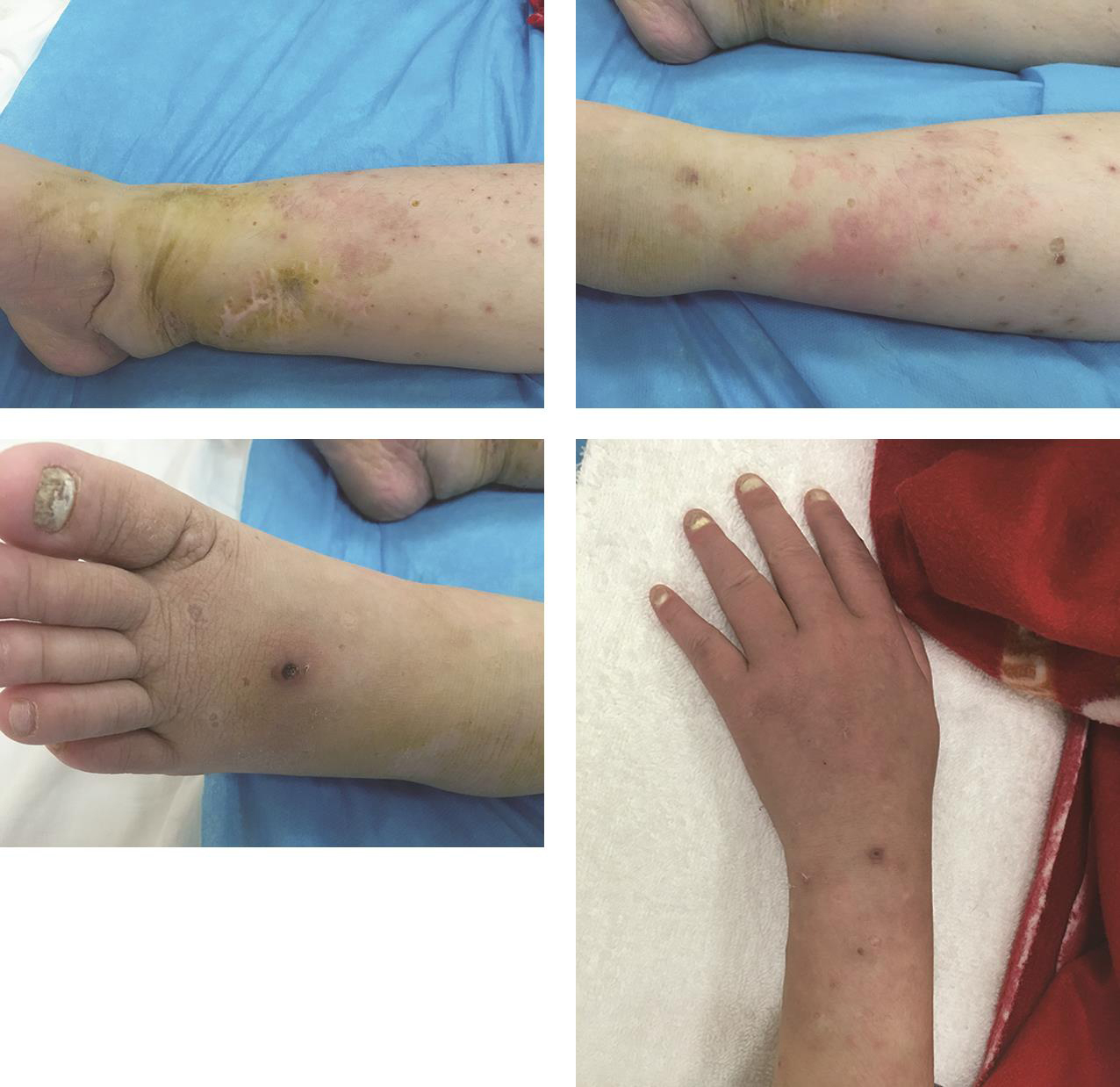
图1 皮疹和灰指/趾甲
(二)实验室检查
1.血常规 WBC 0.4×109/L,Hb 79g/L,PLT 202×109/L,中性粒细胞百分比5.1%,淋巴细胞百分比84.5%。
2.尿常规 白细胞(+),蛋白(+)。
3.大便常规+OB 正常。
4.生化检查(肝功能、肾功能、血糖、血脂、心肌酶学)ALB 31g/L,GLO 26g/L,空腹血糖7.14mmol/L,尿酸496.7μmmol/L,余正常。
5.CRP 98mg/L,ESR 59mm/h,PCT 33.32ng/ml。
6.病原学 梅毒、HIV、呼吸道九联、病毒性肝炎、病毒全套、寄生虫全套、结核抗体、PPD皮试、T-SPOT均为阴性。
7.腹部彩超 肝光点粗,胆囊多发息肉样病变,右肾结石,右肾小囊肿,双肾实质声像改变,双肾集合系统分离。
8.胸片 肺部感染,不排除合并肺水肿,心影增大。
9.肺部CT 双肺多发结节及实变,双侧胸腔积液,心影增大,心包积液(图2)。
10.产科超声 宫内单活胎,ROP,胎儿偏小,胎儿心律不齐,心率增快,羊水偏少。
11.骨髓细胞学检查 骨髓增生减低,粒系明显减少,中性粒细胞缺如,红系增生正常,淋巴增加,可见幼淋(2.5%),网状细胞(2.5%),吞噬细胞(2.5%),血小板成堆分布。血涂片白细胞分布减低,中性粒细胞缺如。
12.心脏彩超 二、三尖瓣轻度反流,微量心包积液。
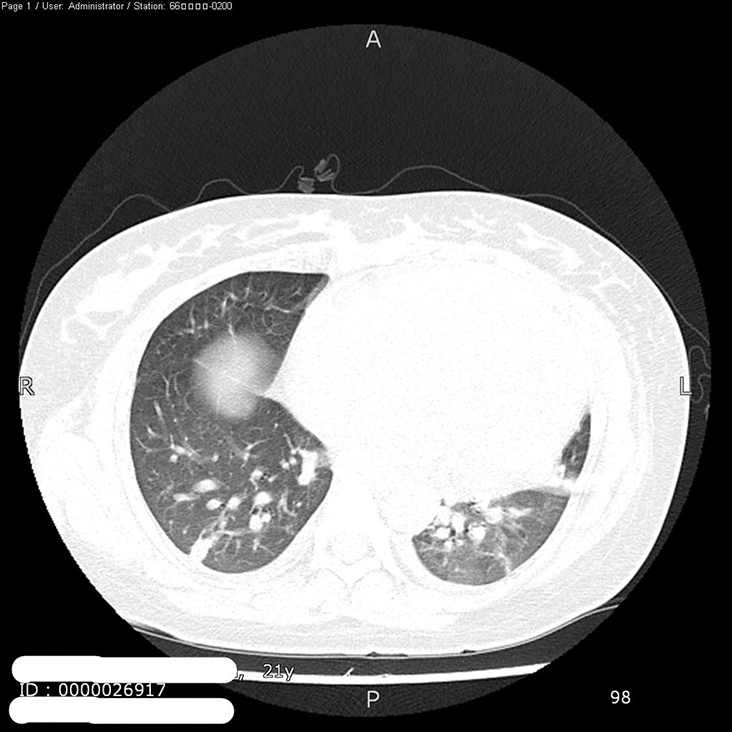
图2 肺部CT
三、临床分析
(一)病例特点回顾
1.年轻女性,妊娠晚期。
2.长程反复发热。
3.伴有皮肤多形性损害(丘疹、结节、溃疡、化脓、凹陷性瘢痕),多系统损害。
4.发热时有乏力、食欲下降、全身不适,热退时明显缓解。
5.中性粒细胞缺如,淋巴分类为主,贫血,PLT正常。
6.PCT、CRP等炎性指标升高。
7.肺部多发病灶,多浆膜腔积液,骨髓细胞学异常改变。
8.抗生素有一定疗效,解热镇痛药可短暂退热,需糖皮质激素和免疫抑制剂维持治疗。
9.多次反复均发生在糖皮质激素减量或停药过程中。
(二)发热伴皮损诊断分析[1-4]
总结患者的病例特点,年轻女性,多年反复发热伴全身多形性皮损,多系统损害,再次发作时伴严重粒细胞缺乏,全身症状,炎性指标明显升高,骨髓细胞学异常改变,既往予抗生素、糖皮质激素和免疫抑制剂可控制病情。发热的原因分为感染性和非感染性,根据该患者的临床特点,其诊断分析如下。
1.感染性疾病
(1)脓毒症
支持点:患者表现为高热伴感染中毒症状,存在长期使用免疫抑制剂、皮肤屏障功能受损、粒细胞缺乏的易感因素,PCT、CRP等炎性指标显著升高,既往皮肤脓性分泌物曾培养出细菌和真菌,抗生素治疗有一定疗效。
不支持点:病程太长,反复发作,予糖皮质激素和免疫抑制剂可控制病情,停用后复发,qSOFA评分仅1分。
(2)结核感染
支持点:ESR增快,肺部多发病灶,胸腔积液,长期免疫抑制剂使用史。
不支持点:结核抗体、PPD皮试和T-SPOT均阴性,糖皮质激素长期治疗并未导致病情加重。
(3)病毒感染
支持点:患者发热、皮疹,淋巴细胞分类为主,有多系统损害,需要考虑传染性单核细胞增多症。
不支持点:粒细胞缺乏,淋巴增殖不明显,病毒学指标阴性。
2.非感染性疾病
(1)结缔组织疾病
1)自身免疫性疾病
支持点:发热、皮疹,感染中毒症状轻、多系统损害、糖皮质激素和免疫抑制剂治疗有效。
不支持点:自身抗体均阴性。
2)自身炎症性疾病[5-7]
支持点:发病年龄小,反复发热、皮疹、多系统损害,炎症因子显著增高,糖皮质激素治疗有效。
不支持点:无家族史。
(2)血液系统疾病
支持点:长程发热,皮疹,贫血,红细胞脆性增加,血红蛋白电泳H增高,粒细胞缺乏,骨髓出现幼淋、网状细胞和吞噬细胞,既往被诊断为血红蛋白H病。
不支持点:病程反复10年,但病情无进展,淋巴结、肝脾肿大等淋巴系统增殖现象不明显,无明显出血、消耗等表现,异常细胞比例未达标准。
四、进一步检查、诊治过程及随访
(一)进一步检查
1.PCT(ng/ml) 17.82(第2天)→9.1(第3天)→4.73(第4天)→6(第6天)→1.5(第12天)→0.05(第14天)。
2.免疫全套IgA 558mg/L,狼疮全套、血管炎三项、抗CCP抗体、ANCA、TnⅠ、BNP、呼九联均正常。
3.凝血功能 纤维蛋白原8.77g/L(升高)、D-二聚体1.06ng/ml(升高)。
4.复查乙型肝炎病毒、丙型肝炎病毒、艾滋病病毒、梅毒抗体、病毒全套均阴性。
5.真菌感染 G/GM试验阴性、皮肤分泌物涂片未见真菌。
6.肥达-外斐反应 阴性。
7.红细胞脆性 完全溶解0.36%(升高),Ham’s试验阴性。
8.营养性贫血 转铁蛋白减少,转铁蛋白饱和度降低,总铁结合力升高,未饱和铁结合力升高。
9.骨髓活检 造血组织容量<30%(造血组织30%,脂肪组织70%),呈骨髓增生低下,脂肪组织增生。造血组织粒、红系增生低下,两系以中晚阶段细胞为主,散在分布。巨核细胞2~4个/HP,为多叶核。个别淋巴细胞、浆细胞可见。Gomori染色(-),铁染色(-)。造血组织增生低下。
10.血培养 3次无菌生长。
11.骨髓培养 无菌生长。
12.痰培养 正常咽喉杂菌。
(二)治疗过程
首先予以美罗培南、利奈唑胺抗感染,继续口服泼尼松(15mg/d)抗感染,粒细胞集落刺激因子升白细胞,柴胡、某退热药辅以物理降温退热,低分子肝素钠抗凝、补液及对症支持处理。住院第7天患者仍高热,粒细胞不升,遂改为头孢哌酮钠舒巴坦钠、氟康唑、多西环素抗感染,加用静脉丙种球蛋白。住院第11天,患者仍持续高热,血象无改善,停用某退热药和多西环素,改泼尼松为地塞米松10mg静滴,继续予以头孢哌酮钠舒巴坦钠、氟康唑抗感染及对症支持治疗,当日起患者体温开始下降,逐渐正常,PCT、CRP、粒细胞逐渐恢复正常,皮疹逐渐愈合,症状消失,精神食欲改善,病情好转出院(图3)。
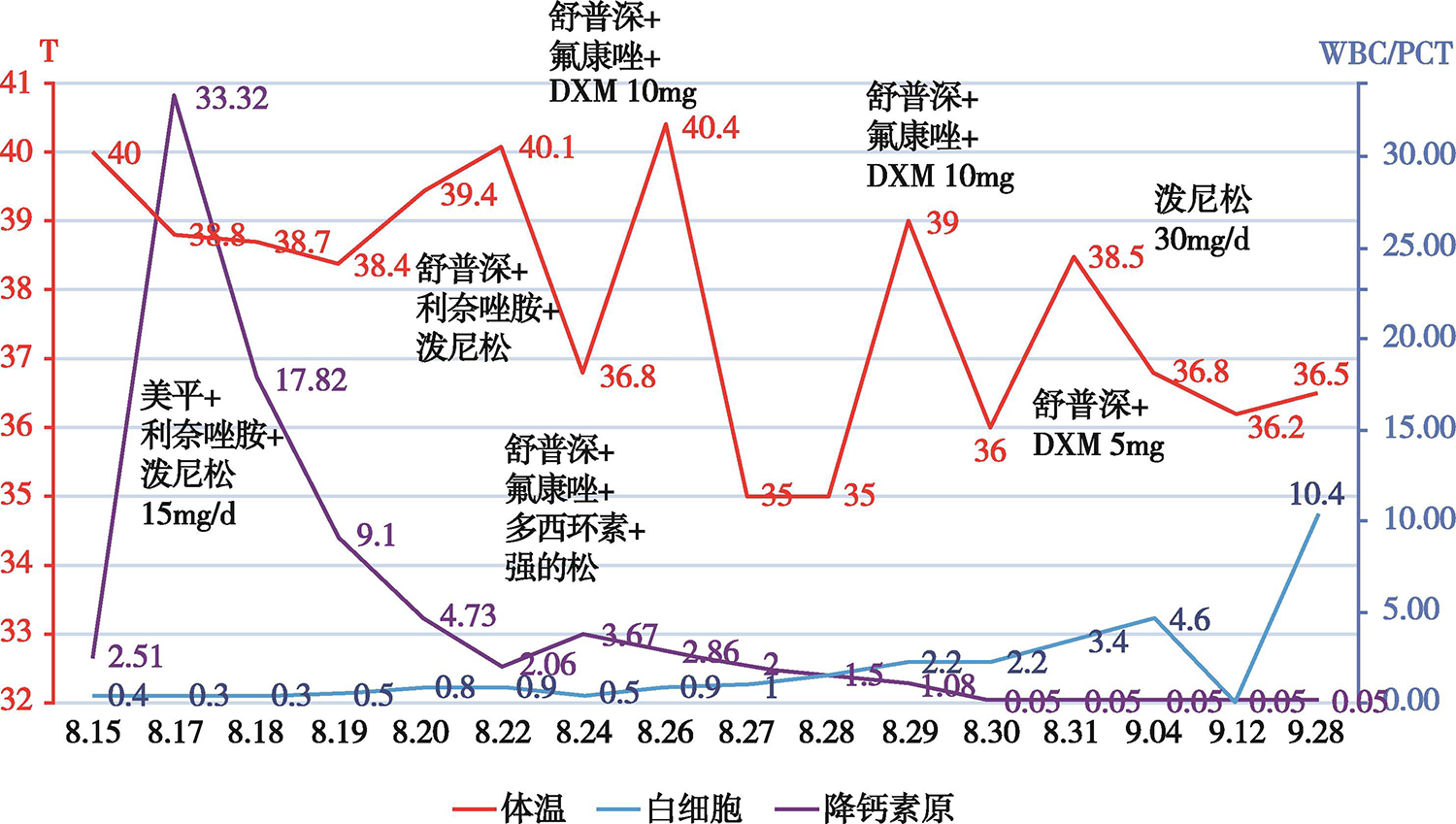
图3 治疗过程中体温、血白细胞和降钙素原的消长
(三)随访
出院时继续口服泼尼松30mg/d,每月减量2.5mg,至20mg/d维持,出院1个月后经剖宫产术娩出一健康男婴,母子平安。出院后4个月复查,各项指标均正常,皮疹消退,灰指/趾甲较前好转(图4)。
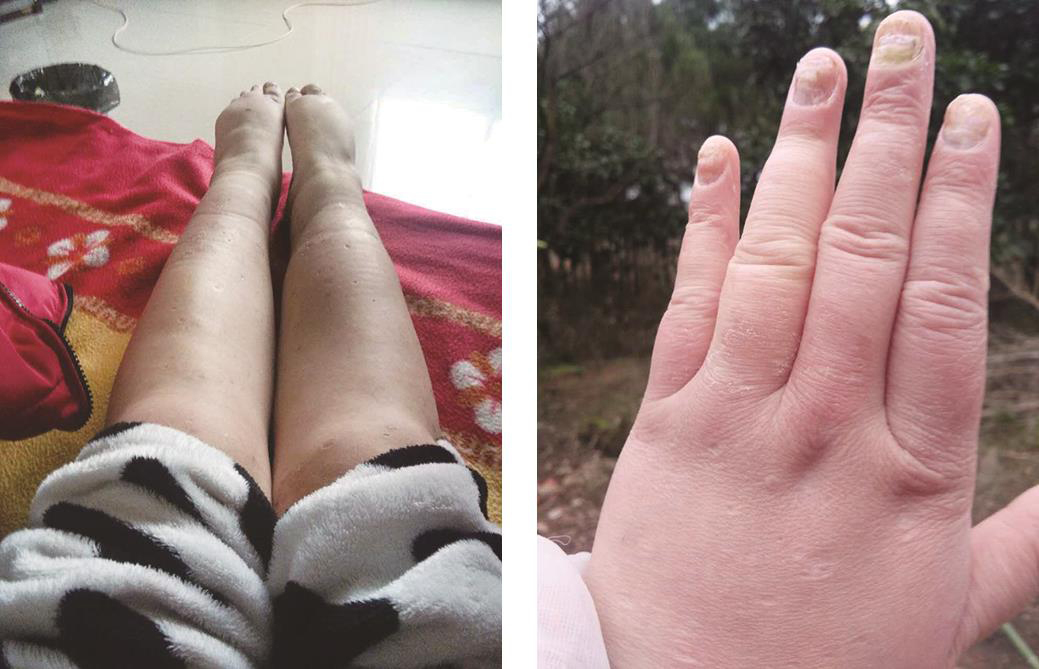
图4 出院后4个月随访
五、最后诊断及诊断依据
(一)最后诊断
1.自身炎症性疾病
2.脓毒症
3.粒细胞缺乏症
4.皮肤指/趾甲真菌感染
5.宫内妊娠31周2天(单活胎)
6.右肾结石、右肾囊肿
7.溶血性贫血、血红蛋白H病
(二)发热皮疹诊断依据
患者长程发热伴多形性皮疹,多系统损害,首次发病年龄小,再发表现为高热伴感染中毒症状。其粒细胞缺乏,长期使用免疫抑制剂,皮肤屏障功能受损,均是感染的易发因素,结合PCT、CRP等炎性指标显著升高,且抗生素治疗后炎性指标逐渐下降,说明存在感染,考虑“脓毒症”。但在炎性指标下降过程中,患者仍然高热,粒细胞不恢复,且多次血液体液骨髓细菌培养均阴性,用感染不能解释。结合其既往反复发作均可用糖皮质激素和免疫抑制剂控制,并需用泼尼松维持治疗,每次复发均发生在泼尼松减量或停用过程中,本次复发亦加大了糖皮质激素的剂量,病情最终得到缓解,需考虑存在非感染疾病。骨髓相关检查未发现血液系统疾病的明确证据,自身抗体均阴性,不支持自身免疫性疾病。反复发热伴皮疹考虑自身炎症性疾病为其原发病,在此基础上继发感染,严重感染导致骨髓抑制致粒细胞缺乏。
六、MDT专家点评
(一)呼吸科
患者年轻女性,病程长达10年,累及多脏器系统,长期使用糖皮质激素治疗,病情无明显加重,消耗症状也不明显,用感染性疾病和肿瘤无法解释。其虽有贫血,但骨髓细胞学检查提示红系正常,贫血原因可能为溶血所致,根据其皮疹特点、病理检查提示血管周围淋巴细胞浸润,原发病需要考虑自身免疫性血管炎,并继发细菌感染,该病自身抗体的产生可干扰骨髓干细胞增殖,致粒细胞缺乏,多脏器损伤也可解释,治疗方案正确,但需要终身治疗。
(二)皮肤科
患者皮肤损害表现为丘疹、结节、脓疱、坏死和凹陷性瘢痕,无紫癜、外阴溃疡及关节痛,两次皮肤病理改变先后表现为表皮水肿坏死,继而增生肥厚,真皮层可见围绕血管壁的弥漫性淋巴细胞炎症浸润,少许嗜酸性粒细胞,个别小血管管壁纤维素样变性,无管腔闭塞、白细胞碎裂、肉芽组织增生,不符合“变应性血管炎”病理改变。体癣和手足癣均为典型改变。结合患者自身抗体阴性,炎症指标明显升高,糖皮质激素治疗有效,原发病考虑免疫相关性疾病或自身炎症性疾病可能性大,皮肤及血管炎改变为其中表现,可完善基因检测明确分型。
(三)风湿科
自身免疫性疾病各年龄均可发病,多伴自身抗体阳性,病情进行性加重,主要累及适应性免疫,为多基因病。该患者青少年期即起病,表现为反复发热、皮疹、多系统损害、淋巴结肿大,累及多个脏器,自身抗体阴性,但炎症因子显著增高,糖皮质激素治疗有效,诊断考虑“自身炎症性疾病”可能性大,又称“遗传性周期性发热综合征”,是一组遗传性、复发性、炎症性、非侵袭性的疾病总称,为单基因病。该炎症无自身抗体的产生,由调节炎症基因的变异所致,使固有免疫失调,从而导致促炎细胞因子过度产生,引起的全身性和/或局部炎症。可借助基因检测加以明确。糖皮质激素、秋水仙碱、TNF及IL-1β阻断剂常有较好的疗效。患者的临床表现和对糖皮质激素的治疗反应支持自身炎症性疾病。
(四)血液科
患者多次检查提示轻中度贫血、血小板正常,红细胞脆性增加,血红蛋白电泳H增高,A2和F正常,骨髓细胞学检查提示红细胞大小不一,网织红细胞百分比增加,伴脾大,Coomb’s试验和Ham’s试验阴性,“血红蛋白H病”是明确的。患者此次虽表现为粒细胞严重缺乏,但反复发作的间歇期粒细胞完全正常,10年病程中病情并未明显进展,经过控制感染、糖皮质激素的应用和刺激粒细胞增殖,各系均很快恢复正常,粒细胞缺乏考虑严重感染诱发的急性造血功能停滞所致。自身免疫性疾病也可以导致粒细胞缺乏,但血小板多同时下降,该患者不支持。患者在妊娠终止前血象已恢复正常,因此粒细胞缺乏与妊娠无关。其他伴有高热的淋巴瘤、多发性骨髓瘤、MDS、恶性组织细胞病等均为恶性程度很高、进展很快的血液系统疾病,白血病很容易通过骨髓细胞学检查诊断,该患者均不支持。
七、经验与体会
患者病史很长,反复发作,予抗生素和糖皮质激素可控制病情,间歇期予糖皮质激素可维持病情稳定,每次复发均发生在糖皮质激素减量或停用的过程中,因此,对于采用糖皮质激素长期维持治疗的自身炎症性疾病患者,在药物减量过程中应密切随诊,避免减量过快和停药。此外,对于涉及多学科的复杂性疾病,诊断时应避免惯性思维,不能简单采用一元论,应考虑更多可能的因素,加强多学科的合作,全面分析,综合治疗。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]万学红.诊断学[M].9 版.北京:人民卫生出版社,2018:8-12.
[2]李兰娟.传染病学[M].9版.北京:人民卫生出版社,2018.
[3]李兰娟.感染病学[M].3版.北京:人民卫生出版社,2015.
[4]张文宏,李太生.发热待查诊治专家共识[J].北京:中华传染病杂志,2017,11(35):641-655.
[5]ADRIANA AJ,SCOTT WC. Molecular mechanisms ingenetically defined autoinflammatory diseases:disorders of amplified danger signaling[J]. Annu Rev Immunol,2015,33(1): 823-874.
[6]ADRIANA DJ,GOLDBACH MR. Genetically definedautoinflammatory diseases[J]. Oral Diseases. 2016: 22(7): 591-604.
[7]CONTASSOT E, BEER HD, FRENCH LE, et al. Interleukin-1,inflammasomes, autoinflammation and the skin. Swiss Medical Weekly, 2012,142(5): w13590.
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.