54岁女性,因发热5天、失明4天入院。如何诊治?有哪些临床思辨要点?
一、入院疑诊
(一)病例信息
【病史】
女性患者,54岁,因发热5天、失明4天入院。患者5天前无明显诱因出现发热,体温最高39℃,偶有干咳,有气短,无咳痰,伴左膝关节疼痛,无关节红肿、关节活动受限现象,无畏寒、寒战,无恶心、呕吐,无腹痛、腹泻,无尿频、尿急、尿痛,无皮疹,未予重视。4天前晨起出现失明,双眼无光感,就诊于当地医院,查眼底超声提示双眼球内异常回声,考虑“玻璃体浑浊?视网膜脱落?脉络膜水肿?”。眼科检查提示双眼无光感、双眼前房积脓。查胸部CT提示双肺感染,以间质病变为主,多发结节,肝内囊性病变。药物治疗不详。后患者仍持续高热并逐渐出现排尿困难,排尿次数减少(由每天4~5次减至每天2次),每次排尿尿量少(具体不详),尿液呈深黄色,无尿急、尿痛。1天前于我院急诊科就诊,实验室检查示血象、CRP增高,胸部CT提示双肺多发结节影、双肺感染、肝内低回声结节,考虑诊断为肺部感染、糖尿病、失明,予亚胺培南西司他丁钠、盐酸万古霉素联合抗感染治疗及盐酸氨溴索化痰治疗,并予吲哚美辛栓肛塞(1次)退热。治疗后,患者体温降至正常,眼科会诊见双前房积脓,大量丝状渗出,考虑为“双内源性真菌性眼内炎?双眼继发青光眼、双眼并发白内障”,为进一步诊治,收入呼吸监护病房。患者自发病以来,精神弱,食欲较差,仅能喝少量粥,睡眠尚可,无头晕、头痛、意识欠清、四肢活动障碍等表现。
患者有糖尿病病史5年,平素血糖控制不佳,近3年使用胰岛素控制血糖,(皮下注射门冬胰岛素30:早上14U、中午4U、晚上12U),空腹血糖控制在8mmol/L,餐后血糖控制在15~17mmol/L。其余情况无特殊。
【体格检查】
体温37.3℃,心率83次/分,呼吸20次/分,血压134/65mmHg。
左膝关节处可见2cm×3cm水泡,周围皮肤无红肿,关节无肿痛。双眼结膜充血、水肿,可见脓性分泌物,以左眼为著;双眼玻璃体浑浊,瞳孔不可见。双上肺叩诊清音,双下肺叩浊,双肺呼吸音粗,双下肺呼吸音减弱,双下肺满布粗湿啰音。心界不大,心律齐,未闻病理性杂音。腹软,无压痛。肝肋下未触及,叩痛阴性。双肾区叩痛阴性。双下肢凹陷性水肿。
【实验室检查】
血常规:WBC 24.67×109/L,N% 90.9%,Hb 123g/L,PLT 250×109/L。
生化:ALT 15U/L,AST 17U/L,Cr 37μmol/L,K 3.07mmol/L,ALB 30.7g/L,血糖 17.53mmol/L。
血沉(ESR)78mm/1h;C反应蛋白(CRP)424mg/L。
弥散性血管内凝血(disseminated intravascular coagulation,DIC)相关检查:凝血酶原时间(prothrombin time,PT)13.2s,血浆纤维蛋白原(plasma fibrinogen,FIB)717mg/dl,D-二聚体(D-dimer)569ng/ml。
【影像学检查】
胸部CT可见多发结节(图1、图2),提示双肺感染。
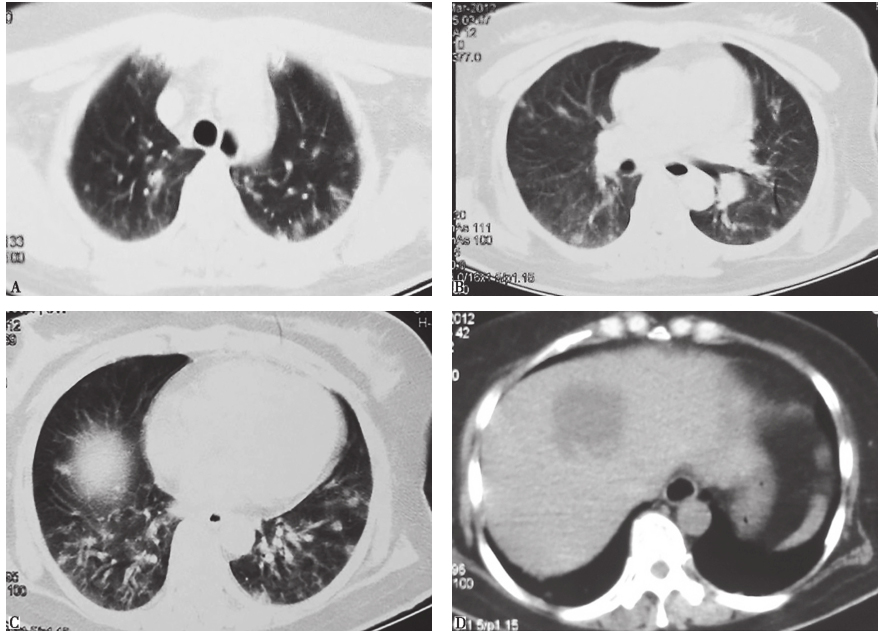
图1 发病第2天胸部CT表现
胸部CT示双肺多发结节样病变,伴磨玻璃样渗出,肝脏可见一低密度病变
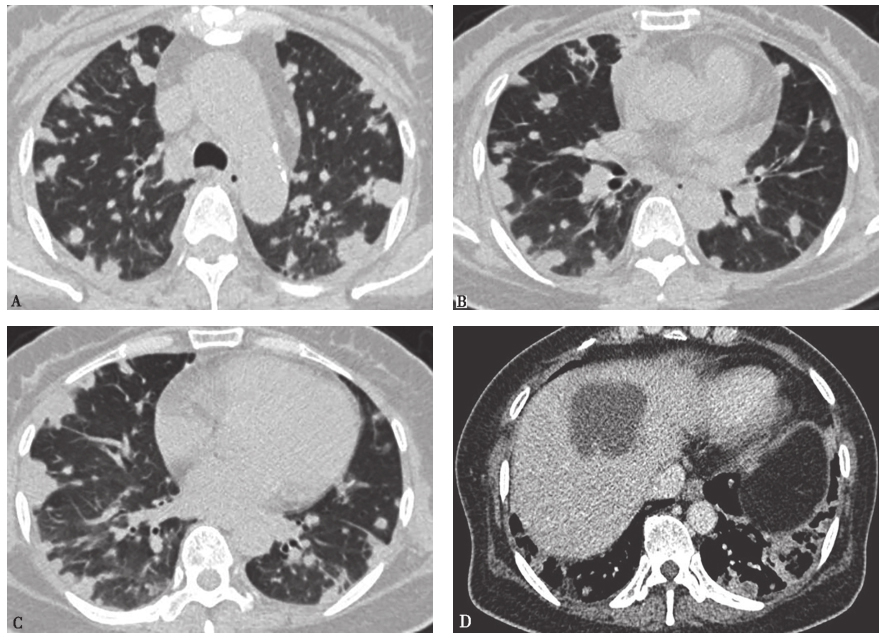
图2 发病第5天胸部CT表现
胸部CT示双肺多发结节样病变较前明显增多,大小不一,胸膜下分布为主,部分中央伴坏死,肝脏低密度病变基本同前
(二)临床思辨
【临床特点】
1.患者为中年女性,急性起病。
2.主要症状和体征为高热、突发双眼失明、尿量减少、左膝疼痛、双肺湿啰音。
3.实验室检查提示外周血白细胞计数及中性粒细胞比例增高,CRP、ESR等炎症指标明显增高。
4.影像学检查显示双肺多发结节伴渗出,病灶进展快,部分结节可见中央低密度影,提示坏死;肝脏可见低回声结节。
【思辨要点】
分析患者特点,以发热、突发失明起病,病情进展迅速,辅助检查提示血象及炎症指标增高,完善检查后见双眼眼内化脓性感染、双肺多发坏死样结节病变,首先考虑为全身多发感染。在确立诊断过程中首先需要思考以下问题。
1.诊断本病例应该注意鉴别哪些疾病?
对于发热合并双肺多发坏死性结节、病情进展迅速的患者,应注意排除风湿免疫病,尤其是韦格纳肉芽肿的可能。这一疾病多合并耳、眼、鼻、喉和(或)肾脏等损伤,肺内病灶表现多样,但固定性肺内病灶演变较为少见,并且很少引起眼内坏死或化脓性病变,进展也很少如本病例般迅速。因此,对于本病例,韦格纳肉芽肿诊断可能性不大,可进一步检查相应临床指标以排除。此外,肿瘤性病变很少在数天内快速进展,因此基本可以排除。
2.本病例如果是全身多发感染所致,那么原发病灶在哪里?
患者双肺多发结节样病变呈随机分布,因此考虑脓毒性肺栓塞或血源转移性肺脓肿的可能。双眼脓性病变不是首发病变,考虑原发感染灶不在双眼。既往有文献报道,在糖尿病患者可以出现症状不明显的肝脓肿,本例患者血糖高,且肝脏有单发低密度病灶,虽无腹痛、肝区叩痛等不适,应考虑肝脓肿合并全身播散的可能,可进一步查腹部B超及CT辅助诊断。另外,患者血糖高,应注意有无皮肤软组织感染导致菌血症进而发生全身多发感染的可能。
3.本病例病因如果是感染,可能是哪种病原体所致?
本例患者双肺多发坏死结节样病变。能够引起肺组织坏死形成脓肿的病原体有限,主要需考虑金黄色葡萄球菌、肺炎克雷伯菌、厌氧菌和结核分枝杆菌、真菌。由于患者病变进展迅速,结核分枝杆菌和真菌感染可以排除。
4.患者入院后,应完善哪些检查?
首先应完善病原学检查,包括血需氧、厌氧细菌培养,痰培养及涂片,脓性分泌物培养及涂片;同时可以查降钙素原、动态红细胞沉降率。如条件许可,应进行支气管镜检查,留取下气道分泌物进行病原学检查。此外,还须完善免疫学检查以排除免疫系统疾病;查糖化血红蛋白(HbA1c),以了解血糖控制情况;完善血气分析,以评估呼吸功能及内环境。
5.对于本例患者,目前的治疗策略是什么?
目前怀疑患者多部位感染,病情危重,应给予充分抗感染治疗(覆盖耐药杆菌及球菌,并兼顾厌氧菌),因此予亚胺培南/西司他汀联合万古霉素,覆盖包括金黄色葡萄球菌(含MRSA)、肺炎克雷伯菌[含超广谱β内酰胺酶(extended spectrum β lactamases,ESBL)]、厌氧菌在内的病原菌。另外,应给予积极对症支持治疗(包括氧疗)。
二、诊治过程及确诊
(一)临床信息
【入院后病情变化】
入院后给予亚胺培南/西司他丁联合万古霉素抗感染,同时给予吸氧及对症支持治疗。入院后患者病情继续加重,发病第6天发生SpO2下降80%(储氧面罩吸氧15L/min),予气管插管辅助呼吸,并出现血压下降至67/52mmHg,予多巴胺升压治疗。发病2周后患者诉左膝关节疼痛,查体见左膝关节皮温较对侧增高,不能自主屈曲活动,左膝关节腔穿刺抽出脓性液体约10ml(图3),抽液后关节肿痛明显好转。

图3 左膝关节腔穿刺液
左膝关节腔穿刺后见脓性穿刺液
【实验室检查】
1.一般检查
血常规:WBC 14.61×109/L,N% 83.9%,Hb及PLT均正常。
尿常规:尿糖> 55mmol/L,红细胞(red blood cell,RBC)0/μl,WBC 0/μl。
ESR :56mm/1h。
肝功能:入院时,AST 41U/L,乳酸脱氢酶(lactate dehydrogenase,LDH)428U/L,γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)138U/L,碱性磷酸酶(alkaline phosphatase,ALP)180U/L,ALB 20.6g/L。
凝血分析:FIB-c 578mg/dl,D-dimer 827ng/ml。
糖化血红蛋白(HbA1c)13.2%。
血气分析(储氧面罩 8L/min):pH 7.56,PaCO2 39mmHg,PaO2 79mmHg, 34.9mmol/L,SO2 97%。
免疫相关检查:血清自身抗体(包括抗核抗体、抗dsDNA、Sm抗体、抗线粒体抗体等)阴性。血清免疫球蛋白和补体均正常。
PCT> 25ng/ml;CRP 321mg/L。
2.特殊检查
支气管肺泡灌洗液细菌培养、痰培养和血培养均为ESBL阴性肺炎克雷伯菌。左膝穿刺液培养阴性。
【影像学检查】
腹部B超提示肝实质内低回声区(4.6cm×4.6cm),边界不清,内回声不均(考虑肝脓肿可能);胆囊结石。
【治疗过程】
患者双眼眼内炎、肺部多发转移性肺脓肿、肝脓肿,并逐渐出现左膝关节腔积脓,炎症指标及降钙素原均明显增高,血及下呼吸道标本均为ESBL阴性肺炎克雷伯菌,考虑肺炎克雷伯菌菌血症合并全身多发脓肿诊断明确。患者入院后病情进展迅速,很快出现呼吸衰竭及感染中毒性休克。鉴于患者肝脏脓肿病灶为单发,考虑原发感染部位为肝脏。
最后诊断:侵袭性肺炎克雷伯菌脓毒症,原发性肝脓肿,双眼眼内炎,转移性肺脓肿,左膝关节转移性脓肿,Ⅰ型呼吸衰竭,感染中毒性休克。
进一步治疗除继续碳青霉烯类或三代头孢抗感染治疗、胰岛素强化治疗控制血糖、机械通气及对症支持治疗外,还需要尽快进行脓肿切开引流治疗。眼科会诊建议,对于眼内炎,除系统性抗感染治疗外局部应用左氧氟沙星滴眼液,并择期手术。因肝脓肿病灶积脓量少且距离心脏较近,手术风险高,加之患者病情危重,肝胆外科会诊建议暂不引流。左膝关节抽取脓液后,疼痛好转。
抗感染治疗4天后,患者体温高峰降低,根据肺炎克雷伯菌药敏结果,抗感染治疗改用头孢哌酮/舒巴坦联合左氧氟沙星;但患者体温再次升高至39℃,遂调整抗感染药物为亚胺培南/西司他汀联合左氧氟沙星,患者体温下降至正常;10天后,抗感染药物改用头孢曲松联合依替米星,次日患者体温再次升高,最高为38.1℃,将抗感染药物调整为碳青霉烯类后,患者体温再次好转;13天后,抗感染药物改用头孢哌酮/舒巴坦联合左氧氟沙星,患者体温维持正常。
经上述治疗,患者症状好转,成功脱机拔管,1个月后复查胸部CT(图4)显示双肺结节样病灶较前吸收好转、数量减少,肝脓肿较前减小。
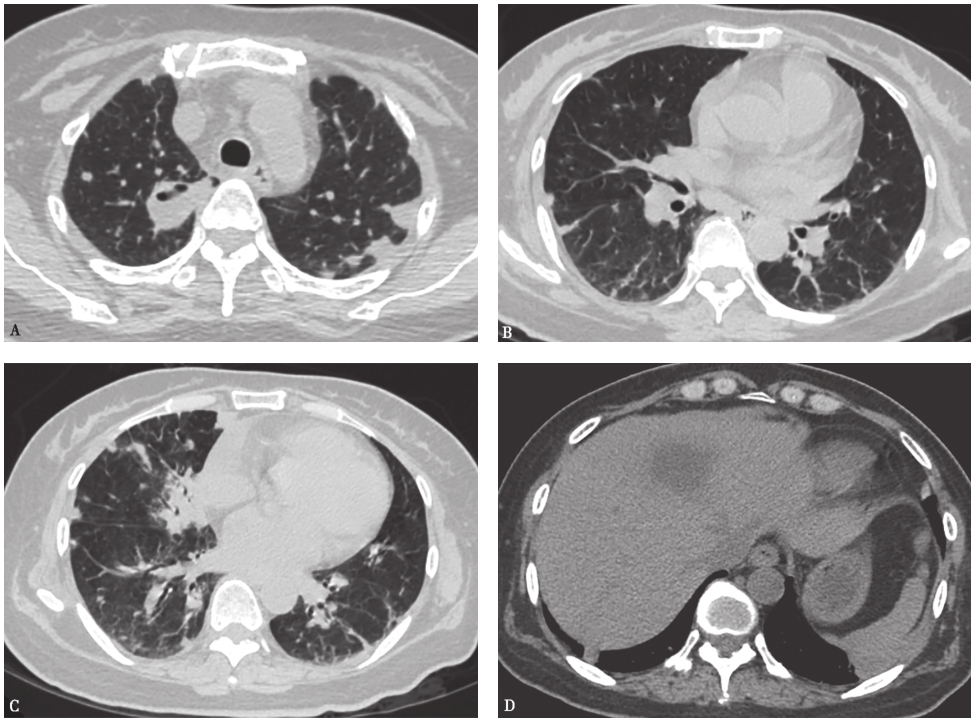
图4 复查胸部CT表现(2012-04-12)
(二)临床思辨
此时需要思考以下问题:
1.本病例为肺炎克雷伯菌感染,为何患者会出现多部位危重感染?
患者有糖尿病,并且平素血糖控制不良,由于细胞免疫水平下降导致易出现重症感染。回顾文献发现,肺炎克雷伯菌已经成为糖尿病患者肺脓肿主要的致病原,而且全球范围内(以东南亚)为主出现了高致病性肺炎克雷伯菌株所致的侵袭性肺炎克雷伯菌综合征,其主要表现为肺炎克雷伯菌菌血症、肝脓肿以及全身转移性脓肿。侵袭性肺炎克雷伯菌含有黏膜黏附力相关基因A(magA)和类黏蛋白调节因子表型A(rmpA)及荚膜血清型K1和K2两种重要的毒力因子,其中magA编码酶是参与荚膜合成的多聚酶,rmpA则是调节荚膜多糖合成的基因。荚膜血清型K1和K2可以增加病菌对吞噬作用、中性粒细胞胞内杀伤作用和血清中细菌补体结合的抵抗。本病例,从标本中分离的肺炎克雷伯菌黏液拉丝实验为阳性,毒力因子基因测定rmpA阳性 (图5),因此确诊为rmpA阳性侵袭性肺炎克雷伯菌感染。
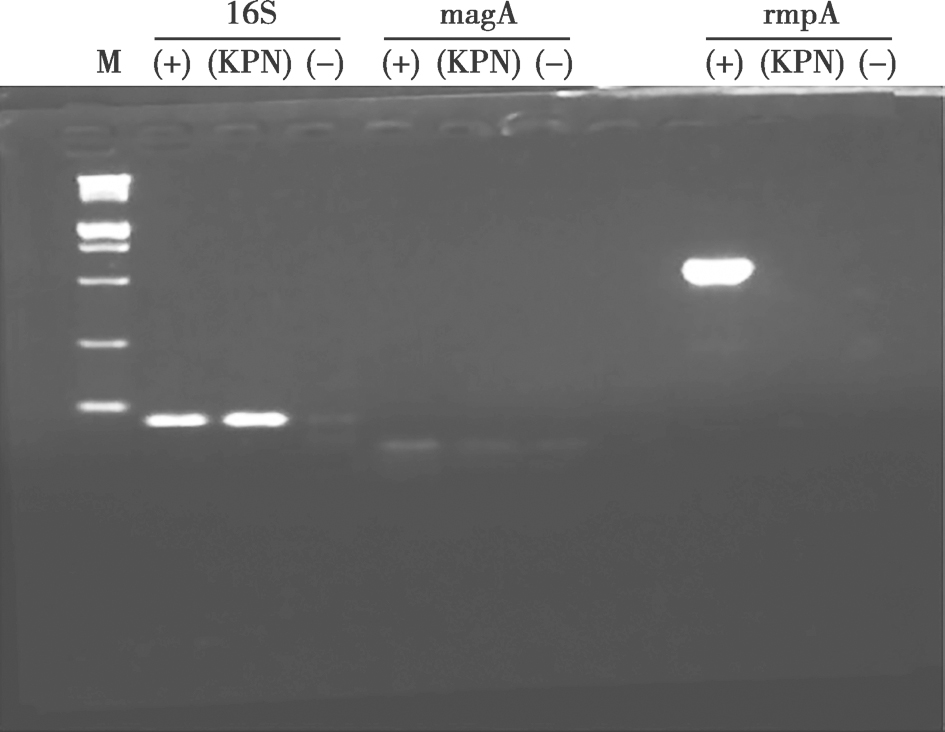
图5 聚合酶链反应结果
M.分子量标志物;+.非侵袭性肺炎克雷伯菌;-.阴性对照双蒸水;Kpn.侵袭性肺炎克雷伯菌
2.如何判定患者感染的初发部位?
肺炎克雷伯菌最常感染的部位包括肺部、泌尿系和肝脏。本病例确诊为侵袭性肺炎克雷伯菌脓毒症,肺部与眼部有血行播散性多发转移病灶,肝脏呈现单一脓肿病灶,故推测其肝脏病灶为初始感染病灶。
3.为何本病例体外药敏试验敏感的药物不能控制病情,而需要应用长时间碳青霉烯类抗感染治疗?
对于全身多发脓肿病变,除应用有效敏感抗菌药物外,脓肿开放引流亦为重要治疗举措,但本例患者因病情限制,肝脏病变不能引流,而肺内脓肿为多发,亦不适宜外科干预治疗,只能以全身抗感染治疗为主,故病情在短期内控制不理想。此外,体外药敏试验中,敏感的药物要在病变局部组织内达到合理的药物浓度水平,需要足够长的疗程,否则难以达到理想的抗感染效果。
精要回顾与启示
本病例的临床症状及初步检查提示爆发性感染,首先明确的是双眼眼内炎、菌血症、双肺多发转移性脓肿。对于糖尿病患者,出现此情况,一定要警惕有无原发性肝脓肿。糖尿病患者合并肝脓肿,腹部症状往往不明显,无腹痛、恶心、呕吐等症状,常在胸部CT及腹部超声检查时发现。目前,国内外文献报道,肺炎克雷伯菌已经成为糖尿病患者发生肝脓肿最重要的致病原,且多为社区获得性感染,大部分为ESBL阴性。有一部分患者同时出现菌血症、肝脓肿及转移性脓肿,菌株接种培养见黏液拉丝明显(可达到5mm以上),提示存在高黏特性,基因学测定可以发现magA或rmpA基因阳性,即侵袭性肺炎克雷伯菌综合征。这个病例提示我们,应认真对待临床疾病个体性表现,注意通过文献回顾加深对疾病本质的认识。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]CHANG FY,CHOU MY.Comparison of pyogenic liver abscesses caused by Klebsiellapneumoniae and non-K pneumoniae pathogens.J Formos Med Assoc,1995,94:232-237.
[2]LIU YC,CHENG DL,LIN CL.Klebsiella pneumoniae liver abscess associated with septic endophthalmitis.Arch Intern Med,1986,146:1913-1916.
[3]YEH KM,KURUP A,SIU LK,et al.Capsular serotype K1 or K2,rather than magA and rmpA,is a major virulence determinant for Klebsiellapneumoniae liver abscess in Singapore and Taiwan.J Clin Microbiol,2007,45:466-471.
[4]YEOH KG,YAP I,WONG ST,et al.Tropical liver abscess.Postgrad Med J,1997,73:89-92.
[5]WONG WM,WONG BC,HUI CK,et al.Pyogenic liver abscess :retrospective analysis of 80 cases over a 10-year period.J Gastroenterol Hepatol,2002,17(9):1001-1007.
[6]LOK KH,LI KF,LI KK,et al.Pyogenic liver abscess :clinical profile,microbiological characteristics,and management in a HongKong hospital.J Microbiol Immunol Infect,2008,41:483-490.
[7]CHUNG DR,LEE SS,LEE HR,et al.Emerging invasive liver abscess caused by K1 serotype Klebsiella pneumoniae in Korea.J Infect,2007,54:578-583.
[8]KIM SB,JE BK,LEE KY,et al.Computed tomographic differences of pyogenic liver abscesses caused by Klebsiella pneumoniae and non-Klebsiella pneumoniae.J Comput Assist Tomogr,2007,31:59-65.
[9]NADASY KA,DOMIATI-SAAD R,Tribble MA.Invasive Klebsiella pneumoniae syndrome in North America.Clin Infect Dis.2007,45(3):e25-e28.
[10]SOBIRK SK,STRUVE C,Jacobsson SG.Primary Klebsiella pneumonia Liver Abscess with Metastatic Spread to Lung and Eye,a North-European Case Report of an Emerging Syndrome.Open Microbiol J,2010,4:5-7.
[11]COUTINHO RL,VISCONDE MF,DESCIO FJ,et al.Community-acquired invasive liver abscess syndrome caused by a K1 serotype Klebsiella pneumoniae isolate in Brazil:a case report of hypervirulent ST23.MemInst Oswaldo Cruz,2014,109(7):970-971.
[12]DULKU G,TIBBALLS J.Cryptogenic invasive Klebsiellapneumoniae liver abscess syndrome (CIKPLA) in Western Australia ? Australas Med J,2014,7(11):436-440.
[13]WANG J,YAN Y,XUE X,et al.Comparison of pyogenic liver abscesses caused by hypermucoviscous Klebsiella pneumoniae and non-Klebsiella pneumoniae pathogens in Beijing :a retrospective analysis.J Int Med Res,2013,41(4):1088-1097.
[14]SHEN DX,WANG J,LI DD.Klebsiella pneumoniae liver abscesses.Lancet Infect Dis,2013,13(5):390-391.
[15]QU TT,ZHOU JC,JIANG Y,et al.Clinical and microbiological characteristics of Klebsiella pneumoniae liver abscess in East China.BMC Infect Dis,2015,15:161.
[16]PODSCHUN R,ULLMANN U.Klebsiella spp.as nosocomial pathogens :epidemiology,taxonomy,typing methods,and pathogenicity factors.Clin Microbiol Rev,1998,11:589-603.
[17]STRUVE C,BOJER M,NIELSEN EM,et al.Investigation of the putative virulence gene magA in a worldwide collection of 495 Klebsiella isolates :magA is restricted to the gene cluster of Klebsiella pneumoniae capsule serotype K1.J Med Microbiol,2005,54:1111-1113.
[18]YEH KM,CHANG FY,FUNG CP,et al.MagA is not a specific virulence gene for Klebsiella pneumoniae strains causing liver abscess but is part of the capsular polysaccharide gene cluster of K pneumoniae serotype K1.J Med Microbiol,2006,55:803-804.
[19]NASSIF X,FOURNIER JM,ARONDEL J,et al.Mucoid phenotype of Klebsiella pneumoniae is a plasmid-encoded virulence factor.Infect Immun,1989,57:546-552.
[20]SIU LK,YEH KM,LIN JC,et al.Klebsiella pneumoniae liver abscess :a new invasive syndrome.Lancet Infect Dis,2012,12(11):881-887.
人卫知识数字服务体系





 Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.