晚期的胆囊癌常可导致肝门部胆道梗阻,由于肿瘤侵犯肝门及邻近血管、较晚的肿瘤分期及存在的合并症,绝大多数该类患者通常无法接受根治性切除术,且具有较短的生存时间和较差的生活质量。大多数患者需要接受姑息性的胆道引流治疗。迄今为止,已有多种引流技术应用于无法手术切除的胆囊癌所导致的肝门部胆道梗阻患者。内镜下胆道引流技术是当前公认的安全且微创的技术。相较于经皮穿刺、外科手术等引流手段,内镜下胆道引流近年来取得了较大的进步,加之新型引流装置或附件的出现,使内镜下胆道引流逐渐成为各大医疗中心的优选治疗方式。
一、适应证与禁忌证
晚期胆囊癌导致明显梗阻性黄疸的患者通常合并多种并发症,在有多种合并症或身体一般条件太差无法耐受内镜手术时,不可强行尝试内镜治疗。
1.适应证 不能根治性切除且伴有肝门部胆管狭窄或梗阻的胆囊癌患者。
2.禁忌证 ①严重的心、肺或肾功能不全者;②严重的胆道感染;③对碘对比剂过敏;④凝血功能异常、精神病发作期;⑤急性胰腺炎或慢性胰腺炎急性发作期;⑥存在上消化道梗阻或狭窄,估计十二指肠镜无法到达十二指肠降部者。
与内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)ERCP引导下胆道支架置入术已经成为缓解胆囊癌所致肝门部胆管狭窄的标准治疗方式,然而ERCP介导下的胆道支架置入术的成功率为85%~95%,一些特殊情况,如十二指肠乳头插管不成功、十二指肠镜无法到达乳头部位、手术导致解剖结构改变或十二指肠梗阻等可导致ERCP失败。超声内镜引导下的胆管引流(endoscopic ultrasonography-guided biliary drainage,EUS-BD)近年逐渐得到关注。EUS-BD的主要优势在于可以从多个角度进入胆管系统,可通过远端食管或胃进入肝左叶胆管系统,并扩张肝左叶胆管,或通过近端十二指肠穿刺进入胆总管内,支架置入可沿着乳头方向顺行插入或沿着肝内方向逆行插入,根据不同患者的实际情况可具体选择。EUS-BD适用于:胆囊癌侵犯或转移致胆管完全梗阻或中断,以及术后解剖结构改变(如行Roux-en-Y吻合术后)等因素致ERCP插管失败,或胆囊癌晚期侵犯十二指肠致十二指肠管腔明显狭窄、镜身无法通过狭窄部位,无法完成ERCP。
二、内镜治疗术式选择及操作技术
(一)内镜治疗常用术式
1.ERCP引导下胆道内支架置入术 根据不同病情及需要选择置入塑料或金属支架。
2.EUS引导下胆管(胆总管或肝左管)穿刺引流术 该技术主要包括EUS引导的会师技术、EUS引导的胆总管十二指肠吻合术、EUS引导下左肝胃吻合术。
3.内镜引导下光动力疗法 光动力疗法(photodynamic therapy,PDT)是近年发展起来的一种新型肿瘤微创疗法,光敏剂借助外周手段进入患者体内并特异性聚集于肿瘤内,然后通过内镜引导的光纤发出一定范围的特定波长,在充分照射之后,光敏剂就会发生相应光动力学效应,进而促进肿瘤细胞发生坏死及凋亡,最终起到局部治疗效果。
4.内镜下粒子植入技术 通过ERCP胆道支架联合粒子植入,粒子内照射能有效抑制肿瘤细胞生长及杀死肿瘤细胞,明显延长支架通畅时间。
(二)内镜治疗操作技术
1.ERCP引导下胆道内支架置入术
(1)行ERCP前,采用纤维或电子十二指肠侧视镜,选用大活检孔道内镜便于放置支架;若选用小孔道内镜则可能无法放置支架。
(2)胆道支架的选择:胆道支架主要有2种,固定直径的塑料支架(plastic stent,PS)和自膨式金属支架(self-expanding metallic stent,SEMS)。SEMS主要用于恶性胆道梗阻,分为全覆膜、部分覆膜和非覆膜3种(图1)。如患者生存期有望超过6个月,推荐使用SEMS,而非覆膜SEMS适用于减轻恶性胆道梗阻。SEMS和PS都可用于治疗恶性胆道梗阻,PS安全、有效,较SEMS便宜,并且发生堵塞时可被替换,但是,PS的主要缺点是过早的堵塞。因为较大的内径,SEMS被用来延长维持胆道引流的时间,因此减少了再次干预的需要。尽管SEMS的价格昂贵,但其随后的复发性胆管炎的发作较少,再次行择期和急诊ERCP的概率较低,需要反复住院的频率和住院时间减少。美国Wallstent多中心研究小组进行的一项随机对照研究提示,PS的堵塞发生率较金属支架高3倍。在笔者的临床实际工作中,通常在如下情况中应用SEMS治疗胆囊癌导致的肝门部胆管狭窄或梗阻患者:①最初置入的PS发生堵塞;②患者身体状况预示生存期超过6个月;③有明确的病理诊断,且胆囊癌侵犯明显或广泛转移,无根治性手术机会。主要推荐使用非覆膜SEMS。覆膜支架可防止恶性肿瘤和良性增生的上皮组织长入支架内部,从而避免支架过早的堵塞,但覆膜SEMS的金属丝并不嵌入组织,致使发生移位的概率较高;而非覆膜的SEMS移位概率低,可用于任何部位(包括肝门部胆管)的胆道梗阻,肿瘤内生长与极难取出是非覆膜SEMS的缺点。此外,覆膜SEMS还可导致对侧肝内胆管或同侧肝内胆管分支的堵塞,不能用来治疗肝门部或肝内梗阻,且堵塞胆囊管和胰管开口所致的胆囊炎和胰腺炎的概率也增加。
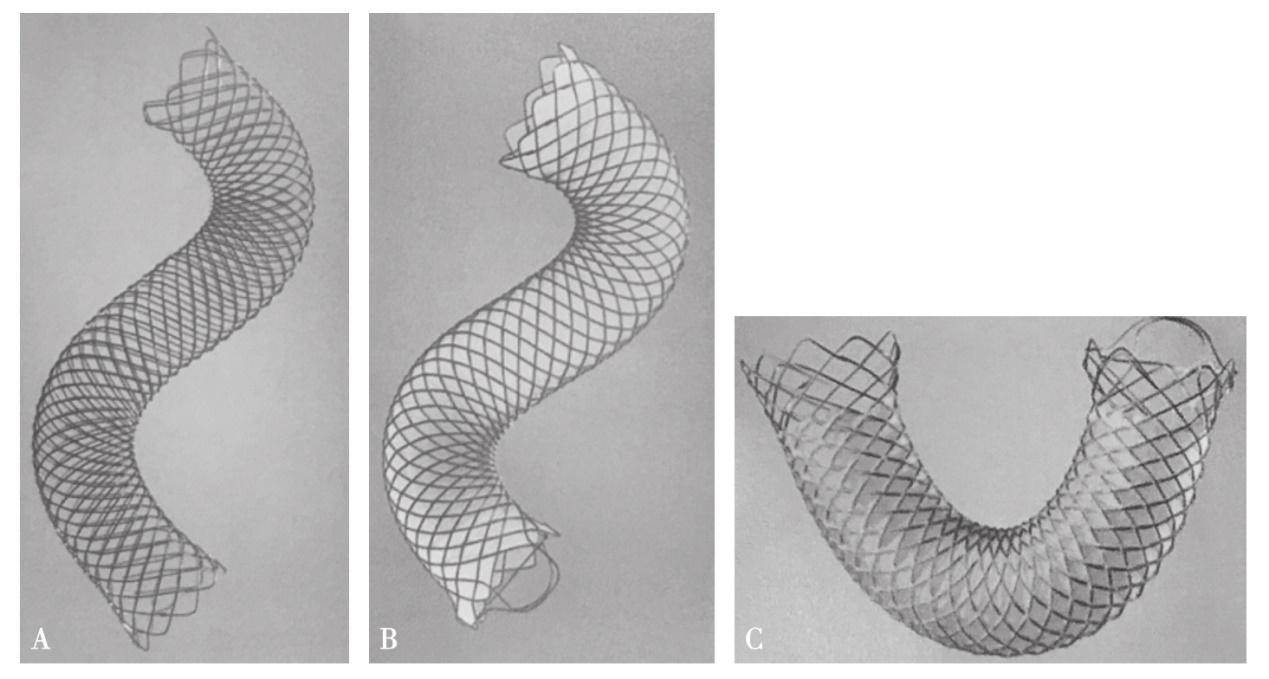
图1 金属胆道支架
A. Wallflex支架,非覆膜;B. Wallflex支架,全覆膜;C. Wallflex支架,部分覆膜。
(3)胆道造影术:高质量的胆道造影对确定胆道梗阻的长度、位置和形状及合适支架的选择均至关重要;在行ERCP的同时,结合腹部磁共振胰胆管成像(magnetic resonance cholangiopancreatography, MRCP)及增强CT扫描肝内外胆管的结果,确定采用单侧或双侧胆道引流。
(4)括约肌切开术:无论SEMS在胆道内还是跨乳头置入,都不一定行胆道括约肌切开术,是否进行乳头括约肌切开的主要依据是能否顺利插管(图2)。
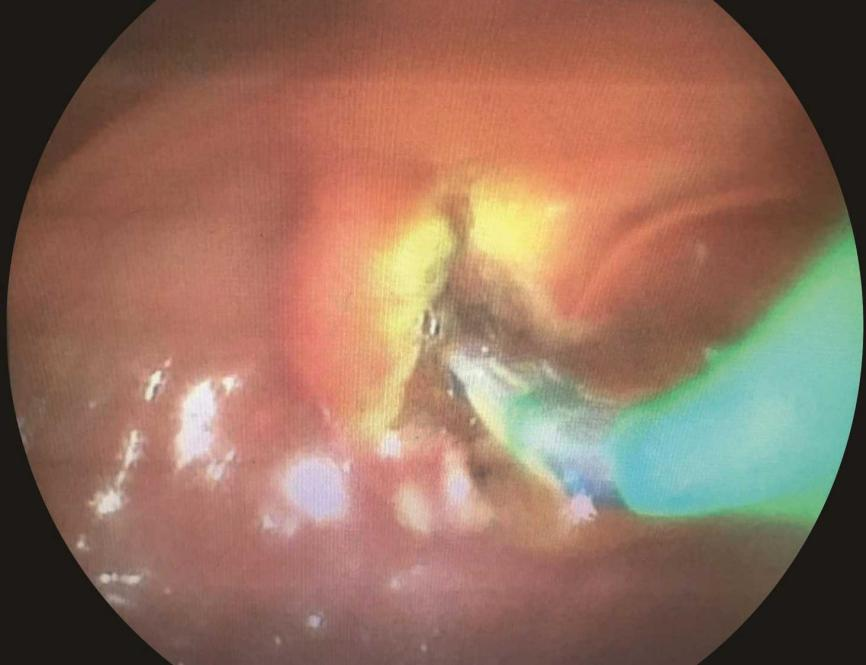
图2 胆囊癌致肝门部胆管狭窄行ERCP置入支架,切开奥迪括约肌
(5)狭窄胆管的扩张:不需要常规为了方便置入SEMS而对狭窄段行扩张,SEMS一般预装在小内径的释放装置中,释放装置容易通过狭窄段,SEMS的扩张力足以使支架在48小时内达到完全或近乎完全张开。
(6)支架与导丝的使用:直径10mm的SEMS最为常用,支架的长度应个体化,取决于狭窄段的长度、位置等,支架的长度在胆道造影后确定,释放并完全扩张的支架应超出狭窄远、近端至少10mm,以阻止肿瘤过度生长导致再次梗阻,应避免支架末端顶在胆管壁或十二指肠壁上。导丝通常用于越过胆道狭窄,以便于导管插入和在器械交换时维持通路,SEMS放置装置通过导丝进入并定位于狭窄处,大直径[0.035in(0.89mm)]、附有亲水层的镍钛合金导丝为首选(图3)。
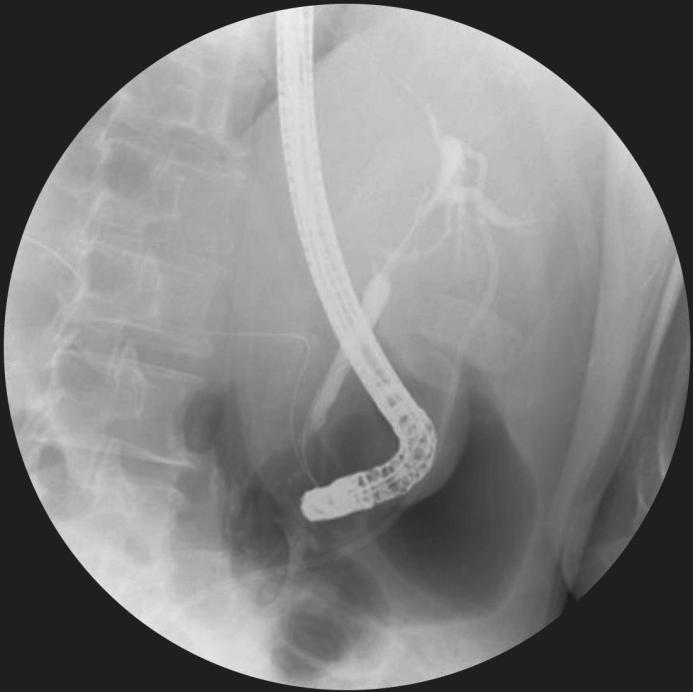
图3 胆囊癌致肝门部胆管狭窄行ERCP置入支架,导丝越过狭窄至肝内
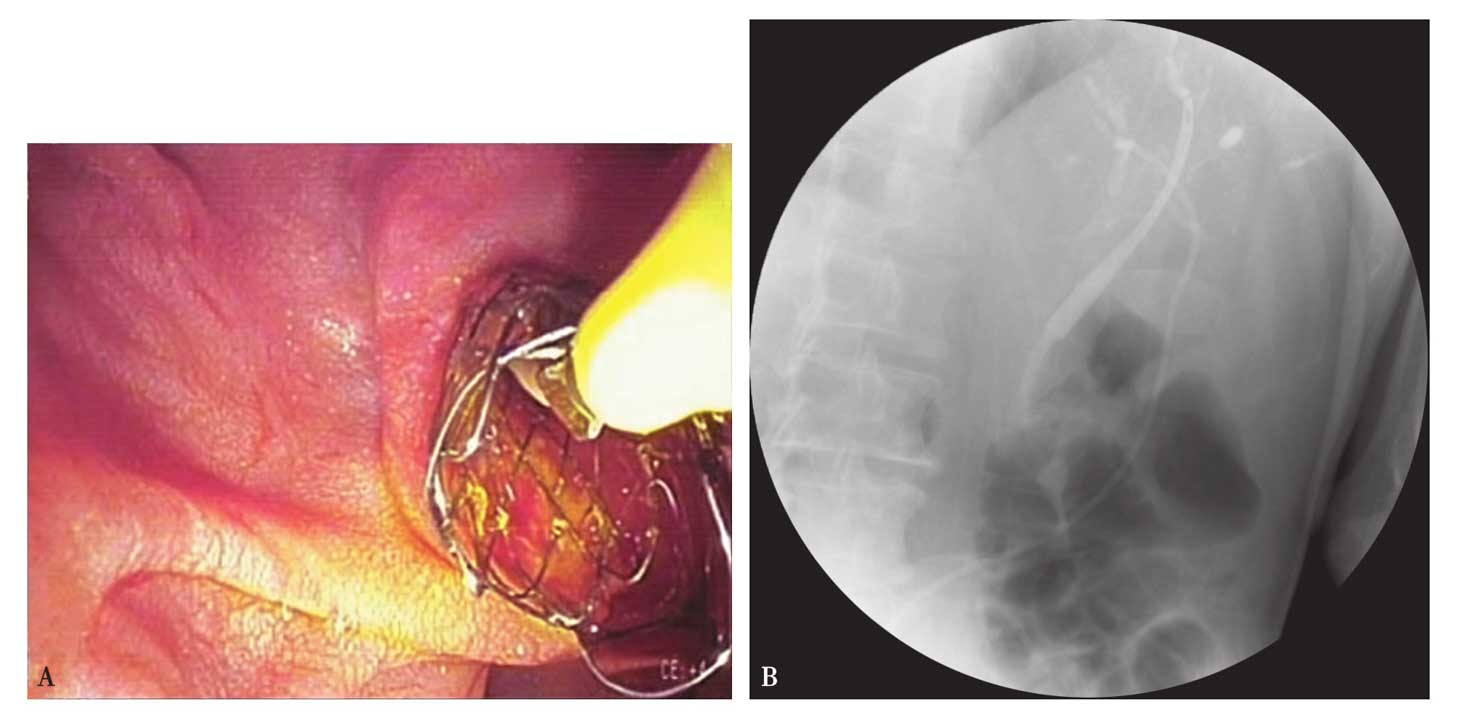
(7)SEMS的定位与释放:针对胆囊癌侵犯肝门部所致狭窄或梗阻的患者,SEMS通常置于乳头上方,由于此时支架的长度不足以跨越壶腹部,支架释放过程通常都需在X线透视和内镜监视下进行,以确保SEMS位置放置准确。当SEMS放置装置到达理想位置时,操作者应逐渐用力退出外鞘管以释放支架,随着外鞘管的退出,支架近端(相对于肝脏)会逐渐张开,此时仍可通过回撤整个支架装置以调整支架向远端移动,释放支架时放松抬钳器以保证外鞘管的顺利回撤,从而完全释放SEMS,随后移除导管及导丝(图4)。
![]()
图4 金属胆囊癌支架置入
A.胆囊癌致肝门部胆管狭窄行ERCP置入胆道金属支架;B.置入胆道金属支架后X线片。
2.EUS引导的会师技术 在超声内镜引导下,使用19G穿刺针(Echo-19,Cook Endoscopy)经胃壁穿刺入左肝管系统,将大直径[0.035in(0.89mm)]、附有亲水层的镍钛合金导丝插入胆管内穿过梗阻病变,在十二指肠内形成环,退出超声内镜,保留导丝在原位。然后,插入十二指肠镜于十二指肠降段,在十二指肠镜的工作通道中放入息肉圈套器抓取导丝,沿导丝行乳头括约肌切开及支架置入术。
3.EUS引导的胆总管十二指肠吻合术 使EUS置入十二指肠降段,在其引导下,将19G穿刺针经十二指肠插入胆总管,抽出胆汁,注入对比剂行胆道造影,将0.89mm的粗导丝插入胆总管内,利用胆道扩张器(Soehendra,Cook Endoscopy)扩张该隧道,通过该隧道将7-10Fr胆道塑料支架或全覆膜SEMS置入该吻合口(图5)。
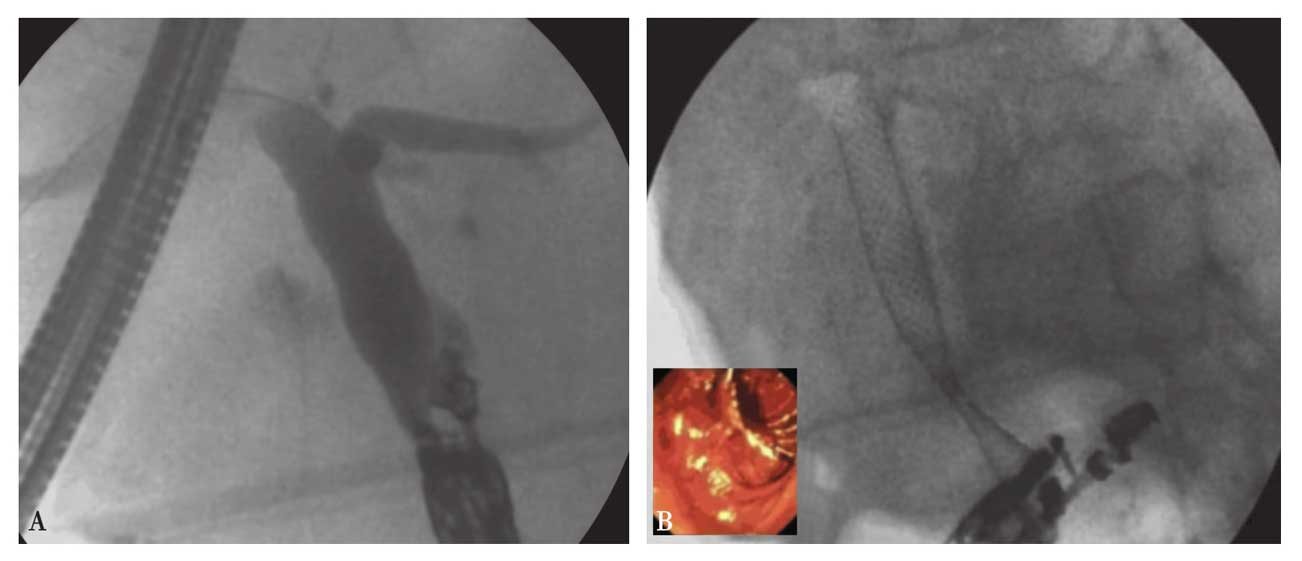
图5 EUS引导的胆总管十二指肠吻合术
A.EUS下照片;B.支架释放后照片。
4.EUS引导下肝左管胃吻合术 将超声内镜置于胃体小弯的中间部分,将19G的穿刺针穿过胃壁插入远端的肝左管,注入对比剂显示扩张的胆管及梗阻的胆道。通过穿刺针导入6.5Fr带绝缘外鞘的导丝(直径0.53mm),采用扩张导管或扩张球囊行胃和肝左管之间的隧道扩张,在扩张胆管的远端与胃的近端形成的隧道内置入8.5Fr、8cm长的肝胃型支架或全覆膜SEMS。为了预防胆瘘,可以通过支架放置6Fr或7Fr的鼻胆管,进行48小时胆管外引流后拔除(图6)。
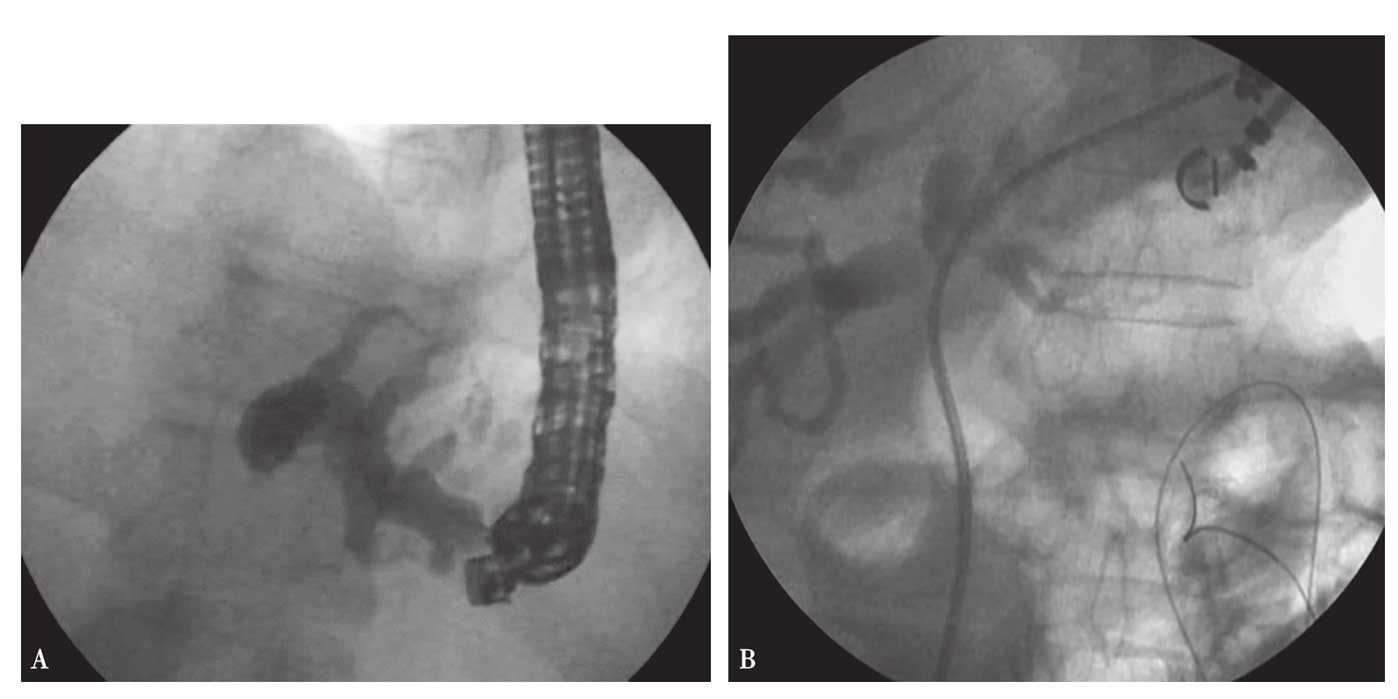
图6 EUS引导下肝左管胃吻合术
A.EUS下照片;B.支架释放后照片。
5.内镜引导下光动力疗法 光动力疗法(photodynamic therapy,PDT)是近年来新型的治疗肿瘤的微创技术,与手术、放疗、化疗等传统治疗方法相比,PDT的优势是靶向杀伤肿瘤细胞,而对周边正常的组织损害较小,其原理在于光敏剂注入机体一段时间后,会特异性地聚集在肿瘤组织内,此时以特定波长的光源激发光敏剂,光敏剂发生光动力学反应,吸收光子能量后的激发态光敏剂可产生多种活性氧物质(氧自由基、单线态氧等)与周围细胞发生反应,引起肿瘤细胞坏死和凋亡,从而起到治疗作用。近年来,随着内镜、超声、CT、MRI引导技术与PDT联合运用,PDT不仅对体表肿瘤具有很好的疗效,而且能治疗腹部实质性脏器、颅内、呼吸道、消化道等深部肿瘤,如在食道肿瘤、胃肿瘤、结直肠癌及肛门肿瘤、胆管肿瘤治疗方面取得较好的效果。近期,有研究以胆囊癌患者为研究对象,评估内镜下PDT的临床效果,对照组患者采用内镜下支架置入术,研究组患者在此基础之上采用光动力疗法,研究显示,PDT能够显著提高患者的生活质量,治疗效果显著,不良反应发生率低,值得在临床上推广应用。
6.内镜下粒子植入技术 胆囊癌导致肝门部胆管梗阻而无法手术切除的患者,ERCP介导下胆道支架置入术是目前非手术治疗的首选方法,然而,胆道支架的置入仅能起到短期内减黄的作用,对肿瘤本身无任何治疗效果,且随着肿瘤的浸润生长,支架可出现狭窄。碘-125(125I)粒子是一种疗效肯定的低能放射粒子,应用于多种恶性肿瘤的治疗。近年来,在探讨125I粒子在治疗胆管恶性肿瘤效果的研究中,所有患者在放置胆道支架成功后均接受组织间125I粒子的放射治疗,在支架置入后8~12天开始植入粒子,粒子植入方式有多种,主要包括B超或CT引导下经皮穿刺植入、超声内镜下植入及小切口直视下植入。植入过程遵循以下原则:粒子尽量呈直线排列,相互平行,各粒子之间等距离(10~15mm);粒子的分布应周围密集,中央稀少,以免出现中心高剂量区而产生并发症;在中心平面上,各粒子之间的中点剂量率之和的平均值为基础剂量。经ERCP胆道支架置入术联合125I粒子是一种崭新的治疗手段,结合了内镜与放疗的特性,充分发挥二者的优势,治疗效果满意,在胆囊癌晚期导致胆道梗阻的患者中,有待开展大样本的随机前瞻性对照研究。
职称:肝胆外科主任 教授 主任医师 医学博士 博士生导师
主要擅长:从事肝胆外科临床工作20余年,对肝胆胰脾外科疾病的诊疗有较深造诣。全面负责科室开展腹腔镜外科、血管介入外科、内镜外科临床工作,并主持开展肝移植、胰肾联合移植、胸腹联体婴儿分离等复杂手术。尤其擅长腹腔镜外科手术(如腹腔镜胆囊切除术、胆道探查术、脾切除术等);肝癌、胆管癌及胰腺癌的外科治疗;门静脉高压症的外科治疗;胆石症的外科治疗;重症急性胰腺炎的诊治;及肝移植、胰腺移植等。
所获奖励:参与多项国家、军队及重庆市科研课题的研究,近年来有关肝癌相关新基因的研究获得自然科学基金课题2项,省部级课题1项;发表SCI收录论著6篇、EI收录论著1篇;在国家统计源期刊发表论著60余篇;获得军队及省部级科技进步奖2项;培养研究生10余名。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]KAWAKAMI H,ITOI T,KUWATANI M,et al. Technical tips and troubleshooting of endoscopic biliary drainage for unresectable malignant hilar biliary obstruction[J]. J Hepatobiliary Pancreat Sci,2015,22(4):E12-E21.
[2]DHIR V,ARTIFON E L A,GUPTA K,et al. Multicenter study on endoscopic ultrasound-guided expandable biliary metal stent placement:Choice of access route,direction of stent insertion,and drainage route[J]. Dig Endosc,2014,26(3):430-435.
[3]SARKARIA S,LEE H S,GAIDHANE M,et al. Advances in endoscopic ultrasound-guided biliary drainage:a Comprehensive Review[J].Gut Liver,2013,7(2):129-136.
[4]ARTIFON E L,FERREIRA F C,OTOCH J P,et al. EUS-guided biliary drainage:a review article[J].JOP,2012,13(1):7-17.
[5]BARON T H,KOZAREK R A.内镜逆行胰胆管造影[M].郭学刚,吴开春,译.2版.北京:人民军医出版社,2015.
[6]中国抗癌协会 .胆囊癌规范化诊治专家共识(2016)[J].临床肝胆病杂志,2017,22(4):611-620.
[7]张卫平,戈伟 .介入治疗联合TACE治疗恶性梗阻性黄疸的临床研究[J].临床和实验医学杂志,2014,13(13):1096-1099.
[8]YANG S,LI N,LIU Z,et al. Amphiphilic copolymer coated upconversion nanoparticles for near-infrared light-triggered dual anticancer treatment[J]. Nanoscale,2014,6(24):14903-14910.
[9]ZHANG C,ZHAO K,BU W,et al. Marriage of scintillator and semiconductor for synchronous radiotherapy and deep photodynamic therapy with diminished oxygen dependence[J]. Angew Chem Int Ed Engl,2015,54(6):1770-1774.
[10]LUKE R,SERGEEVA N N,EDYTA P,et al. Lead structures for applications in photodynamic therapy 6 temoporfin antiinflammatory conjugates to target the tumor microenvironment for in vitro PDT[J].PLOS ONE,2015,10(5):e0125372.
[11]李宏伟,刘川,王朗,等 .光动力疗法在消化道恶性肿瘤中的研究进展[J].实用肿瘤学杂志,2018,32(1):77-81.
[12]LING C C. Permanent implants using Au-198,Pd-103 and I-125:Radiobiological considerations based on the linear quadratic model[J]. Int J Radiat Oncol Biol Phys,1992,23(1):81-87.
[13]赵亚军,赵旭辉,王成,等.经ERCP胆道支架置入术联合碘-125粒子植入治疗恶性梗阻性黄疸的临床应用[J].肝胆外科杂志,2015,23(4):289-291.
人卫知识数字服务体系





 Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.