41岁男性,因“前胸皮疹、发热伴咳嗽、咳痰1个月余”入院。胸部CT可见双肺下叶渗出影、实变影,抗感染治疗和低剂量激素治疗无效,肺部病灶快速进展。在经过一系列诊治后,患者病情急转直下,最终死于呼吸衰竭并多脏器功能衰竭。
【病例简介】
患者男性,41岁,2018年7月19日因“前胸皮疹、发热伴咳嗽、咳痰1个月余”入院。患者2018年6月15日无明显诱因双手指尖及前胸部出现红斑扁平丘疹,有痒感,局部皮温升高,就诊于上海同仁医院予以克霉唑乳膏外用,出疹4~5天后指尖皮疹消退,前胸部皮疹缩小至约7cm×7cm。出现皮疹1周后患者开始夜间发热,最高温度38.5℃,无寒战、大汗,无咳嗽、咳痰等,清晨体温可降至正常;发热3~4天后出现咳嗽、咳黄痰,咽痛,无咯血、呼吸困难等不适。6月22日就诊于外院,查血常规:白细胞:4.43×109/L,中性粒细胞绝对值:3.23×109/L,血红蛋白:134g/L,血小板164×109/L,CRP:5.4mg/L。予以头孢唑啉静脉滴注,头孢克肟口服抗感染,最高体温未下降。6月27日再次复诊,查白细胞:5.69×109/L,中性粒细胞绝对值:4.21×109/L,血红蛋白:126g/L,血小板134×109/L,CRP:16.27mg/L。予以头孢曲松抗感染,未见好转。遂7月5日就诊于华山医院急诊,查胸部X线检查示:左下肺结节,乳头影可能(图1)。遂予以莫西沙星抗感染(7月5日至7月18日)。7月8日查胸部CT示:双肺下叶渗出影、实变影(图2)。超声心动图:左心收缩与舒张功能正常,各瓣膜正常,未见赘生物。痰培养及涂片阴性(细菌+真菌+抗酸杆菌)。此外,患者因咽痛于7月16日行喉镜检查,见咽喉部黏膜充血,舌根及咽后壁淋巴滤泡增生,会厌充血红肿,双侧声带及室带黏膜充血,其余未见异常。患病以来,精神好,胃纳一般,睡眠好,大小便正常,体重明显下降,1个月下降2.5kg。
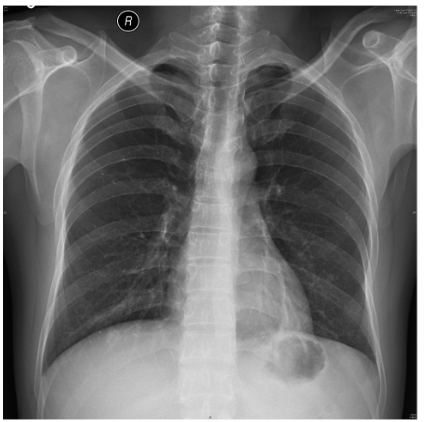
图1 胸部正位片(2018-07-05):两肺纹理增多,左下肺结节,乳头影可能
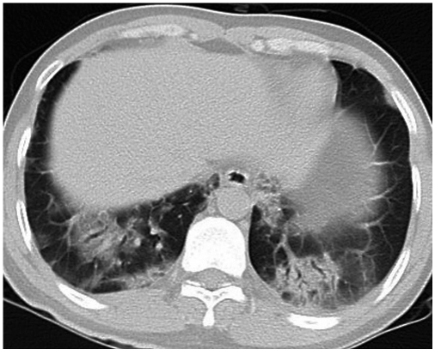
图2 胸部CT可见双肺下叶渗出影、实变影
入院查体:T 38.9℃,P 103 次/min,R 20 次/min,BP 102/60mmHg,MEWS 评分 4 分,身高170cm,体重61kg。神志清楚,发育正常,营养好,步入病房。胸前区可见色素沉着,余皮肤黏膜未见异常,全身浅表淋巴结无肿大。头颅无畸形,眼睑正常,睑结膜未见异常,巩膜无黄染。双侧瞳孔等大等圆,对光反射灵敏,耳廓无畸形,外耳道无异常分泌物,乳突无压痛。外鼻无畸形,鼻通气良好,鼻中隔无偏曲,鼻翼无扇动,两侧鼻旁窦区无压痛,口唇无发绀。双腮腺区无肿大,颈软,无抵抗,颈静脉无怒张,气管居中,甲状腺无肿大。胸廓对称无畸形,胸骨无压痛,双肺呼吸音清晰,未闻及干、湿性啰音。心率79次/min,律齐,各瓣膜听诊区未闻及杂音。腹平软,全腹无压痛及反跳痛,肝脾肋下未触及。脊柱、四肢无畸形,关节无红肿,无杵状指(趾),双下肢无水肿。肌力正常,肌张力正常,生理反射正常,病理反射未引出。
既往史及个人史:患者是铝合金门窗制作工人,否认结核病史及结核接触史,否认粉尘接触史,否认生禽接触史。否认传染病史;否认外伤史;否认食物、药物过敏史;否认中毒、输血史;否认吸烟、酗酒史。否认家族遗传性疾病史。
初步诊断:肺部阴影待查。
【病例解析】
问题1:患者肺部阴影可能的病因是什么?
患者病情特点为发热、皮疹合并肺部阴影,病程1个月;胸部CT可见双肺下叶渗出影、实变影;外院及我院急诊给予抗感染治疗效果不佳。发热合并肺部阴影临床需重点除外常见的肺部感染性疾病、恶性肿瘤和自身免疫相关性疾病累及肺部三大类。因此,为明确诊断,入院后给予以下检查:
-血常规:白细胞:3.78×109/L,红细胞:3.41×1012/L↓,血红蛋白:102g/L↓,血细胞比容:30.9%↓,中性粒细胞:66.9%,淋巴细胞:21.4%,单核细胞:10.6%↑,嗜酸性粒细胞:0.8%,嗜碱性粒细胞:0.3%,中性粒细胞绝对值:2.53×109/L,血小板计数:189×109/L。
-肝功能:谷丙转氨酶:49U/L,谷草转氨酶:67U/L↑,总胆红素:10.7μmol/L,直接胆红素:6.1μmol/L,总胆汁酸:3μmol/L,碱性磷酸酶:89U/L,γ-谷氨酰转移酶:126U/L↑,总蛋白:56g/L↓,白蛋白:27g/L↓。
-C反应蛋白:21.9mg/L↑。
-血沉:30mm/h↑。
-降钙素原:0.16ng/ml↑。
-G 试验:<31.25pg/ml。
-T-SPOT:阴性。
-腹部超声及全身淋巴结检查:肝局部回声增强,(脂肪堆积可能)随访。胆囊、胰腺、脾脏、双肾、膀胱:未见明显异常。双侧输尿管未见明显扩张。左侧锁骨上,右侧颈根部,双侧腋下见淋巴结,随访。左侧颈部、右侧锁骨上、双侧腹股沟、后腹膜未见明显异常肿大淋巴结。
-气管镜检查:支气管镜检示各管腔通畅,未见新生物。行支气管肺泡灌洗送mNGS检查和TBLB活检送病理。
-气管镜远端活检提示:支气管黏膜炎症样改变。
-支气管肺泡灌洗二代测序提示葡萄球菌感染。
-肺穿刺病理:提示机化性肺炎(图3)。
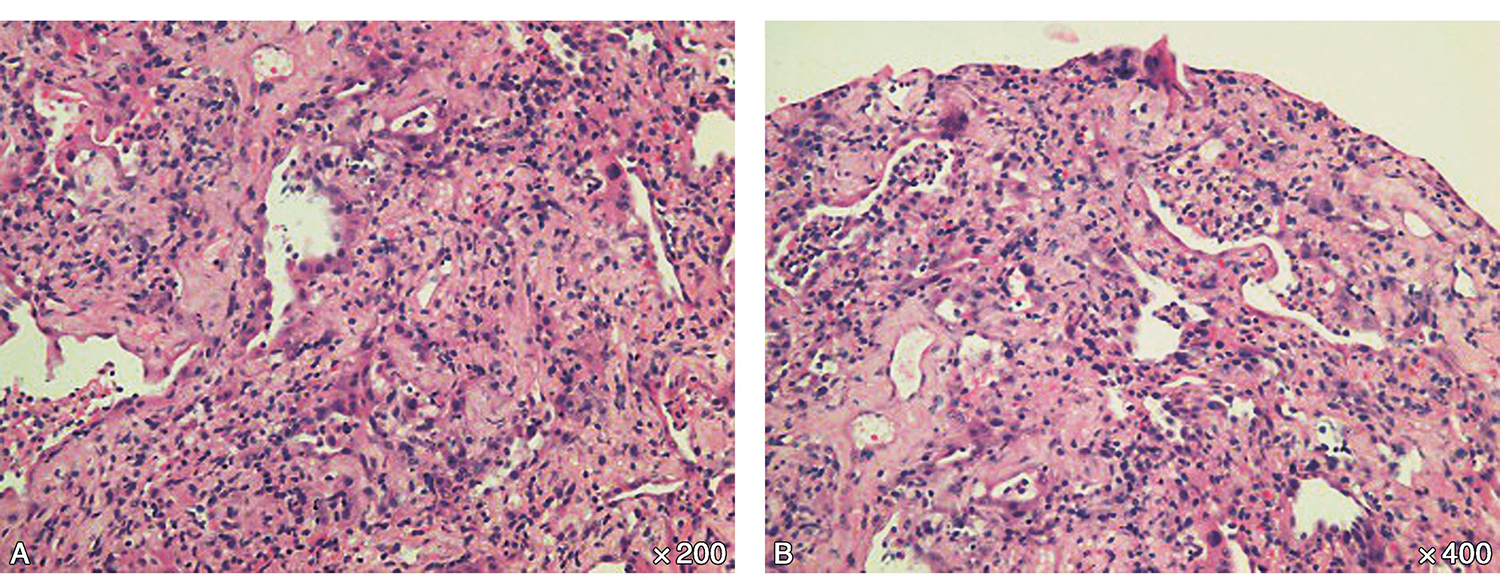
图3 肺穿刺活检病理(A:×200,B:×400):肺泡腔结构消失,间质增生,肺泡腔内可见纤维素样渗出,可见上皮样化生。符合机化性肺炎
入院后,在完善相关检查的基础上首先开始经验性抗感染治疗,予以美罗培南+左氧氟沙星治疗1周,但每日仍有发热,体温高峰波动于38~39℃之间。患者发热时精神状态与不发热时无明显差异。在获得肺穿刺病理和mNGS病原学报告后,抗感染方案改为利奈唑胺,但患者体温仍无改善。在抗感染过程中,复查胸部CT示病灶较前进展且双下肺出现间质性改变(图4)。期间,患者多次复查血常规白细胞及中性粒细胞比例均正常,降钙素原和CRP增高均在3倍以内。
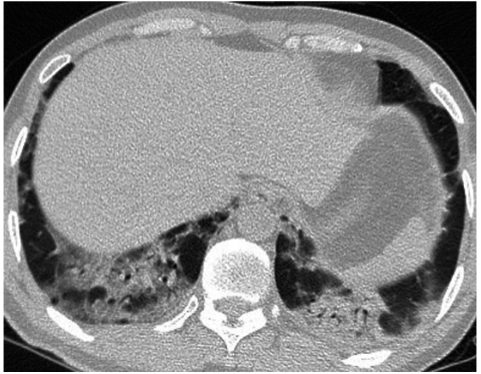
图4 抗感染治疗后半个月复查胸部CT示双肺下叶病灶范围较前扩大,原有部分病灶吸收,另有部分新发病灶,总体病灶进展
问题2:患者能否安全除外肺部感染性疾病?
根据前期入院后患者的诊疗经过,我们可以总结以下特点:①经验性抗感染治疗已经覆盖常见革兰氏阳性及革兰氏阴性杆菌、厌氧菌、不典型病原体;②患者无免疫缺陷基础病,缺乏结核和真菌等病原体感染依据;③肺部病灶较前进展,说明较为广谱且充分的经验性抗感染治疗无效;④患者整体情况较为“逍遥”,缺少感染相应的“毒血症状”;⑤病理提示为机化性肺炎。因此排除感染性疾病,而肿瘤性疾病依据不足,在肺穿刺病理为机化性肺炎的基础上,我们倾向于隐源性机化性肺炎或者自身免疫性疾病继发机化性肺炎的可能。
问题3:患者是否有自身免疫性疾病背景?
在排除感染并考虑机化性肺炎的情况下,我们给予患者糖皮质激素治疗,首先采取的剂量为甲泼尼龙口服12mg/次,2次/d。治疗5天患者体温无改善,仍每日发热,体温高峰波动于38~39℃之间。且在激素治疗期间再次出现眼睑、面颊及前胸皮疹。双侧眼睑为红色斑丘疹,略高于皮面,面颊及胸前为红色充血样皮疹,压之褪色,胸前皮疹分布呈V形。并且诉严重口干,并出现3个口腔溃疡,2个自愈,1个持续。患者自身免疫性疾病相关检查如下:
-抗心磷脂抗体(IgA/G/M):2.8RU/ml。
-抗线粒体抗体分型、肝抗原抗体谱、ANA 抗体谱:nRNP/Sm:阴性(-),Sm:阴性(-),SSA:阴性(-),RO-52:阳性(+++),SSB:阴性(-),Scl-70:阴性(-),PM-Scl:阴性(-),Jo-1:阴性(-),CENPB:阴性(-),抗细胞周期蛋白Ⅰ型抗体:阴性(-),dsDNA:阴性(-),核小体:阴性(-),Histone:阴性(-),核糖体 P 蛋白:阴性(-),M2:阴性(-),M4:阴性(-),M9:阴性(-),抗肝肾微粒体抗体:阴性(-),抗肝细胞溶质抗原Ⅰ型抗体:阴性(-),抗可溶性肝/胰抗体:阴性(-),抗平滑肌抗体:阴性(-)。
-抗核抗体、抗中性粒细胞胞质抗体、CCP抗体、双链DNA定量(2018-07-24):抗核抗体:阳性+,滴度:1∶100,核型:颗粒,胞质;dsDNA 定量:1IU/ml;抗中性粒细胞胞质抗体:PR3:<2RU/ml,MPO:<2RU/ml,cANCA:阴性,pANCA:阴性,CCP 抗体:1.2RU/ml。
-血沉:49mm/h↑。
-C反应蛋白:18.1mg/L↑。
-铁蛋白:>2000.00ng/ml↑。
-肝功能:血清钾:4.1mmol/L,血清钠:129mmol/L↓,血清氯:96mmol/L↓,血清钙:1.96mmol/L↓,血清磷:0.87mmol/L,丙氨酸转氨酶:105U/L↑,天冬氨酸转氨酶:115U/L↑,总胆红素:20.2μmol/L,总蛋白:57g/L↓,白蛋白:25g/L↓,碱性磷酸酶:188U/L↑,γ-谷氨酰转移酶:472U/L↑,尿素氮:4.4mmol/L,肌酐:35μmol/L↓,尿酸:0.04mmol/L↓,二氧化碳结合力:25mmol/L。
-心肌标志物:肌钙蛋白 T:0.04ng/ml↑,肌红蛋白:97.4ng/ml↑,CK-MB mass:5.48ng/ml↑。
-心肌酶谱:肌酸激酶:358U/L↑,乳酸脱氢酶:530U/L↑,α-羟丁酸脱氢酶:361U/L↑。
综合分析患者病情有如下特点:①发热伴皮疹和肺部阴影;②抗感染治疗和低剂量激素治疗无效,肺部病灶快速进展;③自身抗体检测RO-52强阳性,血沉、CRP和铁蛋白显著升高;④伴随肝脏、心肌等多脏器损害。隐源性机化性肺炎为排除性诊断,因为整个病程中,皮疹是首发表现,需要考虑自身免疫病可能。根据患者病情特点,我们主要考虑以下3种自身免疫性疾病:①皮肌炎:入院时患者皮疹已经消退,仅残留胸前部分色素沉着,虽然患者无肌痛主诉,查体肌力正常,但新发分布于上眼睑及胸前V字形皮疹为皮肌炎皮疹的典型区域,进一步查体发现患者双肘伸侧有少量红色斑丘疹,且患者有轻度肌酶升高。综上,皮肌炎诊断应重点考虑。②干燥综合征:患者诉口干严重,且有RO-52抗体强阳性。③白塞病:患者有口腔溃疡。根据以上疾病的诊断标准,患者不足以诊断任何一种自身免疫病。患者体温无改善说明疾病仍未得到控制,因此将糖皮质激素剂量增加为甲泼尼松龙40mg/次,2次/d,静脉推注,并且逐步安排肌肉磁共振、唇腺活检等检查以进一步明确诊断。
在糖皮质激素加量的第3天,患者病情急转直下。突发胸闷气促,指脉氧饱和度87%;在吸氧7L/min的情况下血气分析:pH:7.48↑,二氧化碳分压:4.64kPa↓,氧分压:8.45kPa↓,氧饱和度:93.1%↓,血细胞比容:37%↓,血红蛋白:12.3g/dl,细胞外剩余碱:2.6mmol/L,剩余碱:3.6mmol/L↑,标准碳酸氢根浓度:27.5mmol/L,碳酸氢根浓度:26.3mmol/L,总二氧化碳:27.3mmol/L,肺泡内氧分压:13.67kPa,动脉-肺泡氧分压之比:0.6,携氧量:17ml/dl↓,氧容量:16.1ml/dl↓。患者病情突发进展为呼吸衰竭,给予高流量氧疗(high-flow)并请风湿科会诊,会诊意见考虑无肌病性皮肌炎合并急进性间质性肺炎。进一步完善抗MAD5抗体提示高滴度。这些均支持该诊断。
【治疗】
1.抗感染治疗 美罗培南1.0g/12h,静脉滴注+米诺环素2粒/次,2次/d,口服;
2.激素 甲泼尼松龙40mg/12h,静脉推注;
3.营养支持和对症治疗;
4.呼吸机辅助通气治疗。
【随访】
患者使用激素冲击后2天,发热与氧合情况曾有一过性好转,后病情急转直下,呼吸机辅助通气难以维持氧合,1周后死于呼吸衰竭并多脏器功能衰竭。
【病例点评】
1.无肌病性皮肌炎合并急进性间质性肺炎
经典的皮肌炎需要有皮肤和肌肉的累及,然而无肌病性皮肌炎(amyopathic dermatomyositis,ADM)仅有皮肌炎特有的皮疹而无肌炎的临床或实验室检查证据,是皮肌炎的特殊类型。在这类患者中,肺间质病变发生率相对更高,甚至部分发生快速进展型间质性肺炎,对大剂量糖皮质激素和传统的免疫抑制治疗反应差,病死率高,应给予特别关注。
目前ADM的诊断标准为:出现DM典型皮疹≥6个月,无近端肌无力的临床证据且肌酶水平(肌酸激酶、醛缩酶)正常,肌电图及肌活检亦无肌源性损害的依据;还有部分患者具有皮肌炎的特征性皮疹,通过血清肌酶谱、肌电图或肌活检仅发现亚临床轻微的肌源性损害依据,称之为低肌病皮肌炎(hypomyopathic dermatomyositis,HDM)。排除标准包括:①出现皮肤病变后最初6个月内有连续2个月以上的系统性免疫抑制剂治疗史;②出现皮肤病变时正使用羟基脲、他汀类降脂药等可导致DM样皮肤表现的药物。ADM和HDM合称为临床无肌病皮肌炎(clinically amyopathic dermatomyositis,CADM),目前大多数文献将 CADM的概念理解为ADM,无本质差异。
间质性肺病(interstitial lung disease,ILD)是特发性炎性肌病最常见的并发症。DM患者合并ILD的发病率约在30%左右,而ADM患者发生ILD的概率更大,尤其在东南亚,日本、中国等报道的ADM-ILD发病率多在50%以上。其中快速进展型肺间质病变(rapidly progressive interstitial lung disease,RPILD)病情凶险,在ADM患者中发生的概率明显高于经典DM患者,进展迅速,可在ILD起病后6个月乃至3个月内发展至呼吸衰竭,通常对大剂量激素和免疫抑制剂治疗反应差,可在数月内死亡。本例患者临床经过符合此种类型。据临床观测,部分RPILD患者的肺部病变存在“转型期”,这一时期持续时间较短,患者可能仅有轻度的干咳、气促,影像学表现仅为轻度的实变影或胸膜下线状影;随后在数周内恶化,迅速出现弥漫性肺损伤,表现为进行性呼吸困难和低氧血症,直至Ⅰ型呼吸衰竭。在这一阶段即使应用大剂量激素和免疫抑制剂冲击治疗,不少患者对治疗的反应依然很差,病死率高。若能早期识别“转型期”,及时给予干预治疗,有可能会改善临床结局。影像学上,RPILD患者中,HRCT常见的表现是实变影、磨玻璃影、活动性浸润影、牵拉性支气管扩张征;而下肺网格状影、胸膜下线状影、蜂窝样改变则较易出现在慢性进展型ILD患者中。
目前已知ADM-ILD患者的预后不良因素主要有:①抗MDA5抗体;②血清铁蛋白显著升高;③多处难以愈合的皮损溃疡。2005年日本学者Sato等首次在ADM患者血清中发现一种新的自身抗体,其靶抗原的相对分子质量为140kD,故将其命名为抗CADM-140抗体。后证实抗CADM-140抗体的靶抗原是由黑色素瘤分化相关基因5(melanoma differentiation associated gene 5,MDA5)编码的解旋酶,定位于胞质,因此抗CADM-140抗体亦被称为抗MDA5抗体。它可作为ADM患者的特征性抗体,且抗MDA5抗体阳性提示ADM患者发生RPILD的风险高、预后不良。Meta分析显示抗MDA5抗体预测RPILD的敏感性为77%,特异性为86%;抗体阳性者发生RPILD的风险为阴性者的20倍。高血清铁蛋白也是影响ADM-ILD患者预后的重要因素之一。既往研究显示抗MDA5抗体阳性的ILD患者中,血清铁蛋白水平≥500ng/ml与<500ng>1600ng/ml的5例患者均在10个月内死亡。部分ADM患者会发生皮肤溃疡,常出现在Gottron征的分布部位,如掌指关节、肘关节的伸面,也可出现在甲周、指腹等部位。有研究报道,抗MDA5抗体与皮肤溃疡的出现相关,其OR值达18.3。多处难以愈合的皮肤溃疡往往预示疾病预后不良。此例患者抗MDA5抗体强阳性,白铁蛋白:>2000.00ng/ml,显著升高,与患者的不良预后相吻合。
目前ADM-ILD尚缺乏有效的治疗措施,尤其是临床表现为RPILD的患者。若能在此类患者的转型期早期使用大剂量糖皮质激素及免疫抑制剂、联合使用丙种球蛋白,部分患者的病情能够得到明显控制。
该患者整体病程1个月余,进展迅速,以发热伴皮疹起病。由于无典型肌病表现,给诊治造成了一定难度。治疗中虽及时使用激素联合抗感染治疗,肺部病灶进展仍十分迅速,结合患者抗MDA5抗体高滴度和血清铁蛋白显著升高,属预后较差亚型。
2.发热合并肺部阴影的诊断
发热合并肺部阴影是呼吸科的常见症候群。虽然回顾病史,患者最初以皮疹起病,早期即提示自身免疫病可能。但患者为青年男性、急性病程,且自身免疫性疾病采用糖皮质激素及免疫抑制治疗,也应该在全面排除感染之后进行。因此,充分的病原学检查与经验性抗感染治疗是对此类患者的常规诊疗思路。但同时从这例患者中,应当学习到少见病或者常见疾病的危重或特殊类型的重要性。患者青年男性、皮疹不典型、缺少其他自身免疫相关症状,病情进展迅速,这些都是容易造成误诊的原因。但在定位到ADMRPILD这一疾病后发现,患者皮疹分布特征,早期肺部实变影,显著升高且与CRP、血沉不平行的高铁蛋白血症,持续不愈合的口腔溃疡,都可以成为早期的提示信息。
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]彭云,严冰,刘毅.无肌病皮肌炎相关性肺间质病变研究进展[J].中华风湿病学杂志,2015,19(2):129-132.
[2]KAMIYA H,PANLAQUI O M,IZUMI S,et al.Prognostic factors of idiopathic inflammatory myopathies complicated with interstitial lung disease: protocol for a systematic review and meta-analysis[J].BMJ Open,2016,6(11):e12744.
[3]PARRONCHI P,RADICE A,PALTERER B,et al.MDA5-positive dermatomyositis: an uncommon entity in Europe with variable clinical presentations[J].Clin Mol Allergy,2015,13:22.
人卫知识数字服务体系





 Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
