60岁男性,病程5年,以“反复上腹痛”为主要临床表现;2012一2015年发作3次,诊断为“急性胰腺炎”,并因“急性化脓性胆囊炎”行腹腔镜胆囊切除;2017年4月外院体检发现胰头占位;2017年6月作者所在医院门诊CT、MRCP及EUS均提示胰头占位,胆总管下段狭窄,腹腔多发淋巴结肿大;既往长期大量饮酒,已戒酒5年;入院血常规、肝功能、肿瘤指标检查无异常。该患者所患何病?如何诊治?
一、病例介绍
1.患者基本情况
患者:男性,60岁,汉族,已婚,甘肃兰州人,公务员。
入院时间:2017年6月30日。
主诉:间断上腹痛5年,再发10天。
现病史:患者于5年前(2012年1月)进食油腻食物后出现上腹痛(腹痛性质为钝痛,程度中等,呈持续性),就诊于当地医院,查血清淀粉酶650U/L,诊断为“急性胰腺炎”,予保守治疗后腹痛缓解。2013年11月患者无明显诱因再次出现上腹痛,性质同前,当地医院查血清淀粉酶350U/L,诊断为“急性胰腺炎”,予保守治疗后缓解。2015年8月患者在旅途中无明显诱因再次出现上腹痛,程度较剧,为持续性,当地医院诊断“急性胰腺炎”“胆囊结石伴急性化脓性胆囊炎”,按胰腺炎治疗1周并行腹腔镜胆囊切除后出院。2015一2017年,患者偶有上腹饱胀不适,未治疗,定期行上腹部CT平扫+增强扫描或MRI随访,无特殊异常发现。2017年4月,患者于当地医院复查上腹部CT平扫+增强扫描及MRCP均提示胰头占位,遂于2017年6月来我院就诊,再次行上腹部CT平扫+增强扫描及MRCP,均提示胰头占位可能,胆总管下段截断,胰管、胆总管扩张。2017年6月患者在我院门诊行EUS,提示胰头占位,主胰管、胆总管扩张,腹腔多发淋巴结肿大。患者为进一步诊治于2017年6月30日在我科住院治疗。
既往史:无特殊。
个人史:饮酒20年,每天1~2两(50~100g);吸烟20年,每天20支;2012年戒烟、戒酒。否认肝炎、结核或其他传染病史,否认过敏史;否认滥用药物史,否认输血史。
家族史:否认高血压、糖尿病、慢性肾病等家族史,家族中无类似疾病患者。
入院前特殊检查:CT检查和MRCP检查(图1)。
.jpg)
图1 上腹部CT检查和MRCP检查(2017年6月)
a、b. 上腹部 CT;c. MRCP
2.入院查体
腹部可见腹腔镜手术瘢痕,其余无特殊。
3.入院辅助检查
血常规、尿常规、粪常规、生化全套、免疫五项(IgA、IgG、IgM、补体C3、补体C4)、自身抗体、T-SPOT均正常,CA199及CEA正常。
4.初步诊断思维过程
(1)入院时病情总结
患者为60岁男性,病程5年,以“反复上腹痛”为主要临床表现;2012—2015年发作3次,诊断为“急性胰腺炎”,并因“急性化脓性胆囊炎”行腹腔镜胆囊切除;2017年4月外院体检发现胰头占位;2017年6月我院门诊CT、MRCP及EUS均提示胰头占位,胆总管下段狭窄,腹腔多发淋巴结肿大;既往长期大量饮酒,已戒酒5年;入院血常规、肝功能、肿瘤指标检查无异常。
(2)入院时诊断思路
①患者为老年男性,近期影像学检查发现胰头占位,MRCP表现为典型的“双管征”,不能排除胰腺癌;②患者病程5年,反复出现上腹痛,既往大量饮酒,影像学检查提示胰管扩张,不能排除慢性胰腺炎;③患者病程5年,反复发作胰腺炎,胰腺局灶性增大,伴有胆管狭窄,不能排除自身免疫性胰腺炎。
(3)入院初步诊断
①胰腺癌?②慢性胰腺炎?③自身免疫性胰腺炎?
5.后续检查
(1)血清IgG 4水平
12g/L(正常参考值:0~2g/L)。
(2)超声内镜引导下细针穿刺活检术(endoscopic ultrasonography-guided fine needle aspiration,EUS-FNA)
内镜下见十二指肠乳头未见异常;胰腺头部见一低回声病变,边界欠清,横截面大小约3.09cm×2.72cm,多普勒显示少许血流信号,弹性成像为3分;胰腺体部主胰管直径3.0mm;体部及尾部胰腺萎缩;胆总管下段管壁增厚明显,腹腔内可见多发肿大淋巴结(图2)。EUS-FNA病理学检查:胰腺多量血凝块内见少量小肠黏膜;胰腺穿刺涂片,多量红细胞内见极少数异性细胞;十二指肠乳头,小肠组织示慢性炎。免疫组化:十二指肠内淋巴细胞表达IgG(+),IgG4∶IgG<40%,IgG4<50个/HP(图3)。
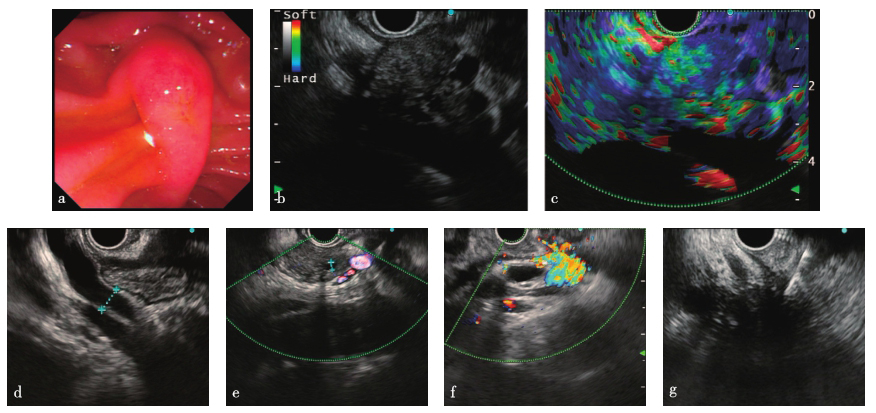
图2 EUS-FNA检查
a. 十二指肠乳头;b. 胰腺头部占位;c. 胰腺头部占位弹性成像;d. 主胰管;e. 胆总管;f. 腹腔多发淋巴结;g. FNA穿刺
.jpg)
图3 十二指肠乳头活检组织IgG4免疫组化(100×)
(3)ERCP
胆总管下段狭窄,狭窄段长约3cm,狭窄以上的胆总管及肝内胆管轻度扩张,胰管轻度扩张(图4)。
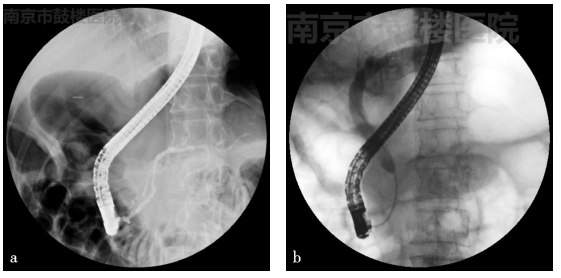
图4 ERCP结果
a. 胰管造影;b. 胆管造影
(4)胆管内超声(intraductal-ultra sonography,IDUS)
狭窄处胆管壁呈明显均匀增厚,胆管壁浆膜层完整(图5)。
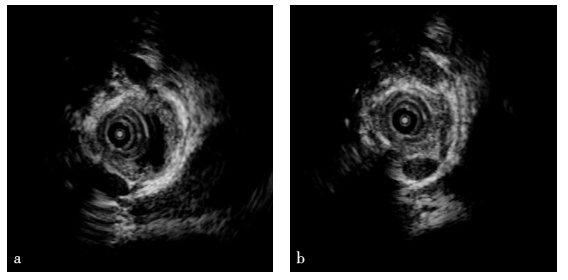
图5 胆管内超声结果
6.最终诊疗思维过程
患者为老年男性,CA199正常,胰头占位在影像学上不符合胰腺癌表现,胆总管狭窄为均匀性狭窄,而非偏心性狭窄,EUS-FNA未见恶性依据,故可排除胰腺癌及胆管癌;CT、MRCP及EUS未见慢性胰腺炎典型的影像学表现,如胰管结石、胰腺钙化等,胰管ERCP未见典型慢性胰腺炎胰管改变,无胰腺炎内外分泌功能异常,故可排除慢性胰腺炎;无自身免疫性胰腺炎(AIP)的胰腺弥漫性腊肠样改变,仅表现为胰头占位性改变,未见肿块的低密度边缘,胰管有扩张,EUS-FNA病理不支持AIP,暂不考虑AIP。
老年男性患者,血清IgG4大于正常上限6倍,自身抗体、肿瘤指标均正常,胆道ERCP提示胆总管下端局灶性均匀性狭窄伴胆管壁增厚,符合IgG4相关性硬化性胆管炎表现(IgG4-SC);胰头占位性改变考虑为胆总管胰腺段的炎性增生,排除胰腺癌、胆管癌、慢性胰腺炎、原发性硬化性胆管炎(PSC)。
7.最终诊断
IgG4相关性硬化性胆管炎(IgG4-SC)。
8.后续治疗方案
根据2015年发表在Arthritis Rheumatology上的《IgG4相关性疾病国际指南共识》,糖皮质激素为IgG4-SC的一线治疗方案。对于该患者,初始予泼尼松龙40mg qd,维持4周,后每2~4周减量5mg。在激素减量过程中,患者病情出现反复,IgG4再次升高,但激素加量后,IgG4水平迅速下降,激素缓慢减量中,目前(2018年9月)用量为10mg/d,后续可逐渐减量至5mg/d维持。
9.后续随访
患者于2017年7月12日开始服用泼尼松龙40mg,q.d.,当时IgG4水平为12g/L(正常参考值:0~2g/L)。2017年9月13日复查IgG4为1.35g/L。2018年9月的IgG4水平为0.54g/L。患者服用激素后一般情况好,未再有腹痛发作,定期复查血常规、生化全套、CA199均正常。复查影像学提示胆管狭窄情况明显好转(图6)。
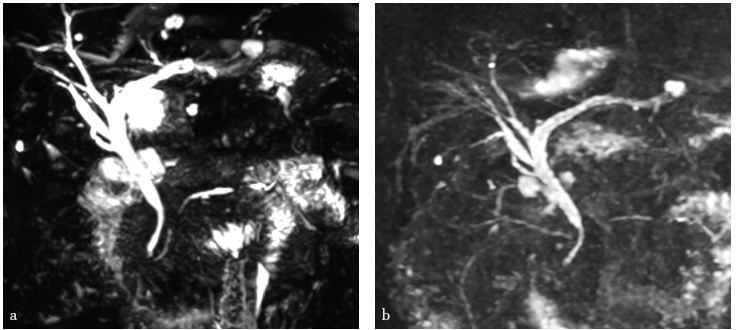
图6 MRCP检查
a. 2017年10月17日;b. 2018年1月19日
二、疾病诊疗难点
该病例起病隐匿,临床表现不典型,为少见病,影像学表现具有迷惑性。
临床上,遇如下情况,需要考虑IgG4相关性疾病,进行IgG4的检测(表1)。
表1 IgG相关性疾病的线索和临床处置

三、疾病知识回顾
IgG4相关性硬化性胆管炎(IgG4-SC)是IgG4相关性疾病(IgG4-RD)中的一种,居IgG4-RD的第6位(13%),主要见于胆总管胰腺段及下段,近端胆管(肝门部胆管及肝内胆管)受累可能性相对较小。IgG4-SC好发于老年男性(男女比例4∶1),90%以上的患者在60岁以后被诊断。以血清IgG4升高、组织内IgG4+浆细胞浸润、胆管周围席纹状纤维化等为特征。影像学特征为肝内外胆管呈节段性狭窄。发病机制涉及自身免疫反应,患者对免疫抑制剂应答良好。IgG4-SC常合并其他脏器IgG4相关性疾病(如AIP等)。
1.IgG4-SC临床表现
IgG4-SC患者通常表现为梗阻性黄疸,尤其是合并胰腺炎者。对于IgG4-SC多器官受累或出现非特异性腹痛的患者,胆管受累常在影像学检查中不经意间发现,这与原发性硬化性胆管炎(PSC)不同,后者常在晚期出现肝硬化时才被发现。血清IgG4升高是诊断IgG4-SC敏感性及特异性最高的实验室检查。有研究发现,血清IgG4水平大于正常值4倍,对于IgG4-SC具有100%的诊断特异性。
2.IgG4-SC的诊断
目前IgG4-SC的诊断标准有两种——HISORt标准和日本标准。两者之间存在细微差别,但大体一致。日本标准更加针对IgG4-SC:
(1)胆道造影显示肝内和(或)肝外胆管广泛或局灶性狭窄伴胆管壁增厚。
(2)血清 IgG4水平升高(>135mg/dL)。
(3)合并自身免疫性胰腺炎、IgG4相关泪腺炎/唾液腺炎或IgG4相关后腹膜纤维化。
(4)组织学检查显示:①显著淋巴和浆细胞浸润和纤维化;②IgG4阳性浆细胞浸润(>10 IgG4+浆细胞/HPF);③席纹状纤维化;④闭塞性静脉炎。
可选项:糖皮质激素治疗有效(需严格影像和组织学检查,排除其他疾病)。
确定诊断须符合如下 4 种组合:(1)+(3);(1)+(2)+(4)①、②;(4)①、②、③;(4)①、②、④。
可能诊断:(1)+(2)+ 可选项。
可疑诊断:(1)+(2)。若病理结果亦无法给予明确诊断,可以在排除恶性病变后尝试采用糖皮质激素治疗。尤其应注意,最初激素治疗前必须排除胆胰癌的可能。该患者在使用激素前排除了胆管癌、胰腺癌、PSC等诊断,同时糖皮质激素有效,证实了IgG4-SC的诊断。
3.IgG4-SC的治疗
IgG4-SC的治疗原则与1型AIP基本相同。大剂量(30~40mg/d)激素治疗能获得快速且持续的症状缓解,极少数难治性IgG4-SC患者可能对激素无反应。亚洲国家推荐疾病缓解后,激素用量经过数月的逐步减量,最终减至2.5~10mg/d的维持量,至少维持1~3年。而西方国家则建议以5mg/w的速度减至0后迅速停药。该例患者激素使用已达1年,在激素减量过程中病情有反复,IgG4再次升高,但加量激素后,IgG4水平迅速下降,激素缓慢减量中,目前用量为10mg/d,后续可减量至5mg/d维持3年。
30%~50%的IgG4-SC患者在激素减量过程中或停药后出现复发,特别是在最初的2年内。复发的危险因素包括IgG4水平上升、近端胆管狭窄等。复发后,使用大剂量激素能获得较好疗效,其他治疗包括使用硫唑嘌呤、吗替麦考酚酯等免疫抑制剂,但目前尚无可信数据证实其有效性。利妥昔单抗被认为是治疗IgG4-RD最有潜力的药物,可应用于无法耐受大剂量激素或有高复发风险的患者。IgG4-SC与恶性肿瘤的关系也是需要研究的另一个问题,近期有研究表明,在最初3年内,IgG4-SC患者的恶性肿瘤发病率并无明显上升,但仍需更长随访时间的研究证实是否存在累积效应。
综上所述,IgG4-SC是一种罕见病,已引起越来越多的关注,未来仍需更多研究探讨其长期结局及最佳治疗方案。
专家点评
该病例病史资料完整,辅助诊断完善,诊断依据充分,治疗处理得当,密切随访,充分反映出作者对于这类疾病中诊断思路清晰、逻辑性强。患者为老年男性,血清IgG4大于正常上限6倍,自身抗体、肿瘤指标均正常,胆道ERCP提示胆总管下端局灶性均匀性狭窄伴胆管壁增厚,符合IgG4相关性硬化性胆管炎(IgG4-SC)表现,胰头占位性改变考虑为胆总管胰腺段的炎性增生,排除胰腺癌、胆管癌、慢性胰腺炎、PSC,最终诊断为IgG4相关性硬化性胆管炎。作者抽丝剥茧,最终明确诊断,患者也获得了良好的治疗效果。经验总结及分析引用最新的文献数据、指南,分析透彻,非常好!IgG4-SC是一种罕见病,已引起越来越多的关注,未来仍需更多研究探讨其长期结局及最佳治疗方案。该病例的临床资料十分完整,确定为IgG4相关性疾病(考虑为IgG4-SC),值得临床医师学习,有较好的指导意义。
IgG4相关性硬化性胆管炎是一种发病机制尚不明确的硬化性胆管炎,属于IgG4相关性疾病中的一种,其特征为血清IgG4水平升高,组织学的特点主要为胆管周围IgG4阳性浆细胞和淋巴细胞浸润、纤维化。患者多因梗阻性黄疸伴有腹部不适就诊,诊断需结合血清学、组织病理学、影像学表现及对糖皮质激素的治疗反应进行综合判断。作者对该患者的诊断较符合对该病症的思维过程,基本病史内容完整,辅助检查资料基本完整,诊断、依据及治疗方法合理,特别是进行了EUS-FNA,在病理组织中找到IgG4阳性细胞的表达。
我们知道,IgG4相关硬化性胆管炎常合并有AIP。典型的AIP影像学表现是“弥漫性腊肠样改变”,但部分AIP是表现为胰腺局限性肿块影。该患者近期的多次影像检查均提示胰头有明确的占位,ESU-FNA胰腺标本中仅见到“血凝块及小肠黏膜”,并没有见到胰腺组织,所以并不能完全排除IgG4相关性硬化性胆管炎合并AIP。虽然治疗方案没有差异,但还是需要注意诊断的完整性,后续随访过程中也应加入胰腺MRI检查。
该病例最终诊断为IgG4-RD,但根据提供的CT图片显示动脉胰头肿大,宽度较均匀,胰头周围少许淋巴结肿大(提示炎症样淋巴结),胰头被膜稍有增厚及毛糙,加上弹性超声的改变,提示该患者有AIP可能,超声穿刺未能取到满意的胰腺组织,故未有AIP的组织学证据,但并不能排除AIP的诊断。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1] KHOSROSHAHI A,WALLACE Z S,CROWE J L,et al. International consensus guidance statement on the management and treatment of IgG4-Related disease[J]. Arthritis Rheumatol,2015,67(7):1688-1699.
[2] STONE J H 1,ZEN Y,DESHPANDE V. IgG4-related disease[J]. N Engl J Med,2012,366(6):539-551.
[3] OSEINI A M,CHAITEERAKIJ R,SHIRE A M,et al. Utility of serum immunoglobulin G4 in distinguishing immunoglobulin G4-associated cholangitis from cholangiocarcinoma[J]. Hepatology,2011,54(3):940-948.
[4] CHARI S T,SMYRK T C,LEVY M J,et al. Diagnosis of autoimmune pancreatitis: the Mayo Clinic experience[J]. Clin Gastroenterol Hepatol,2006,4(8):1010-1016.
[5] OHARA H,OKAZAKI K,TSUBOUCHI H,et al. Clinical diagnostic criteria of IgG4-related sclerosing cholangitis 2012[J]. J Hepatobiliary Pancreat Sci,2012,19(5):536-542.
[6] TANAKA A,TAZUMA S,OKAZAKI K,et al. Clinical features, response to treatment, and outcomes of IgG4-related sclerosing cholangitis[J]. Clin Gastroenterol Hepatol,2017,15(6):920-926.
[7] BLEDSOE J R,DELLA-TORRE E,ROVATI L,et al. IgG4-related disease: review of the histopathologic features, differential diagnosis, and therapeutic approach[J]. APMIS,2018,126(6):459-476.
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
