44岁男性,双下肢水肿10个月,既往无慢性肾脏病史,以大量蛋白尿、低白蛋白血症、水肿起病,如何诊治?
主诉
双下肢水肿10个月。
现病史
患者10个月前无明显诱因出现双下肢水肿,就诊于当地医院,查尿蛋白(+++),镜检红细胞5~10/HP;尿蛋白定量 11g/d,血清白蛋白 26.1g/L,血肌酐65μmol/L,eGFR 123ml/(min·1.73m2),血脂升高,血压升高至190/120mmHg,予泼尼松60mg每日1次治疗3个月,效果不佳,后加用环磷酰胺口服100mg/d至累积量6g,仍无效。于7个月前在外院行肾穿刺活检,病理示肾小球微小病变(7个肾小球)。后停用环磷酰胺,应用环孢素治疗,血药浓度95.6~280ng/ml,监测尿蛋白定量6.4~14g/d,血清白蛋白16~26g/L。环孢素共应用4个月,效果不佳。2个月前患者改用他克莫司2mg每日2次治疗,尿蛋白7.37g/d(尿量 850ml),血清白蛋白 18.6g/L,血肌酐 110.4μmol/L,eGFR 66.8ml/(min·1.73m2)。 患者为进一步治疗就诊我院。自发病以来,精神、食欲、睡眠欠佳,尿量500~600ml/d,体重增加4kg。
既往史和家族史
无特殊。
入院查体
血压125/80mmHg,脉搏80次/min;双肺清;心界不大,心率80次/min,律齐,未闻及杂音;腹平,肝脾肋下未触及,移动性浊音(-),肠鸣音正常;双下肢对称性、重度、可凹性水肿。
初步诊断
难治性肾病综合征 微小病变肾病? 慢性肾脏病2期 肾性高血压
诊断思路和临床诊治经过
患者为中年男性,既往无慢性肾脏病史,以大量蛋白尿、低白蛋白血症、水肿起病,临床符合肾病综合征诊断。在除外恶性肿瘤、感染、自身免疫性疾病等因素后考虑为原发性肾小球病,行肾穿刺活检提示为微小病变肾病。本次入院后再次针对继发因素完善相关检查:感染筛查中除抗-HBs、抗-HBc阳性,余均阴性,HBV-DNA<1 000copies/ml;血、尿免疫固定电泳(IFE)未见单克隆免疫球蛋白区带;肿瘤标志物正常,腹部B超及胸片未发现占位性病变;抗核抗体谱阴性,抗磷脂酶A2受体抗体阴性。考虑患者为原发性肾小球疾病可能性大。
但该患者经过足量规律的激素联合免疫抑制剂(包括环磷酰胺、环孢素及他克莫司等)治疗后,肾病综合征仍未缓解,属于难治性肾病综合征。此时,需要从“病、症、药、人”四个方面来分析。①“病”即病理类型:该患者曾行肾穿刺活检,提示微小病变肾病,但此次活检肾小球数较少(<10个),存在误诊可能性,且微小病变肾病多数对激素治疗反应较好,与该患者临床表现不符,故该患者可能存在病理类型为局灶节段肾小球硬化症(FSGS)可能,需重复肾活检明确。②“症”即并发症:患者存在高脂血症,甲状腺功能正常;病程中无明显感染表现;肾功能较起病时下降,但无明显急性肾损伤表现;血栓方面无临床表现,入院后完善检查D-二聚体及FDP正常,双下肢血管及肾静脉均未发现血栓证据。故该患者并发症导致药物治疗效果不佳的可能性小。③“药”即药物的剂量及使用方法:该患者应用足量激素及多种免疫抑制剂,环磷酰胺累积量已达6g,环孢素应用共4个月,血药浓度达标,目前应用他克莫司,入院后查血药浓度为4.2ng/ml。考虑患者药物治疗基本规范且疗程充分。④“人”即患者个体差异:少部分患者对治疗效果不佳,但需除外以上三个因素后再考虑个人体质差异因素。
重复肾活检病理结果:免疫荧光:免疫球蛋白和补体均阴性;HBsAg(-),HBcAg(-)。光镜:见24个肾小球,肾小球系膜细胞和基质轻度弥漫增生,基底膜空泡变性,其中3个节段性硬化,内皮空泡变性,足细胞增生肥大,球囊粘连。肾小管上皮空泡及颗粒变性,多灶状刷毛缘脱落。肾间质水肿。小动脉管壁增厚。符合:FSGS(NOS)伴肾小管损伤。电镜:结合免疫荧光和光镜检查,符合局灶节段性肾小球硬化症(图1)。继续应用泼尼松20mg/d联合他克莫司3mg/d治疗,维持他克莫司血药浓度在5~10ng/ml,同时予螺内酯及托拉塞米利尿,缬沙坦和氨氯地平降压治疗。考虑患者易发生血栓栓塞并发症,予低分子肝素抗凝,后改为华法林[3mg,隔日1次(单日);1.5mg,隔日1次(双日)],目标INR 1.8~2.0。
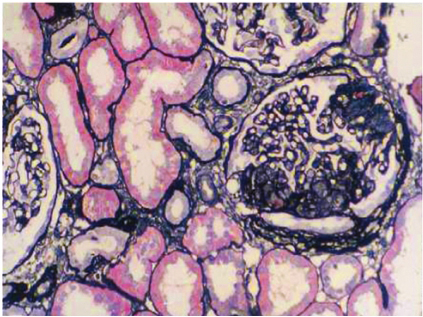
图1 第二次肾活检:肾小球毛细血管袢节段性硬化(PASM×200)
最后诊断
肾病综合征
局灶节段性肾小球硬化症NOS型伴急性肾小管损伤
慢性肾脏病2期
肾性高血压
讨论
正如本例患者,部分难治性肾病综合征患者在病程中会经历两次或以上肾穿刺活检,第一次诊断为微小病变肾病,激素及免疫抑制剂效果不佳后重复肾穿刺,第二次诊断为FSGS。针对这两种病理类型间的关系,目前尚存在争议。一种观点认为微小病变肾病与FSGS是同一疾病的不同表现,取决于疾病开始阶段肾脏损伤的程度不同;另一种观点从两种疾病的发病机制出发,认为这是两种完全不同的疾病。根据目前的研究进展,我们更倾向于第二种观点。临床工作中,首先应该排除病理技术造成的误判(如肾小球数量不够、读片欠细致等)。
从发病机制方面,微小病变肾病与特殊T细胞亚群分泌的细胞因子有关,另有研究针对患者肾小球足细胞,例如有研究发现足细胞过度表达缺少唾液酸的血管生成素样4(angiopoietin-like 4,Angptl 4)与发病相关。另一方面,FSGS是一大类异质性疾病,原发性FSGS的发病可能与循环中可溶性尿激酶受体(soluble urokinase receptor,suPAR)增多有关,因其可激活足细胞上的β3整合素(β3 integrin)导致足细胞足突融合,但是,suPAR在继发性FSGS和其他肾脏病患者中也有升高,其临床意义尚需进一步研究。另外,少部分成年人原发性FSGS或家族性FSGS的发病与足细胞上某些分子单基因突变有关,除此之外,有研究者发现微小病变患者足细胞表达抗肌萎缩蛋白聚糖减少,而FSGS与正常对照一致,且足细胞RhoA蛋白持续激活与FSGS发生和蛋白尿程度有关。发病机制不同,也解释了这两类疾病从临床表现、病理特征,到治疗反应的差异。部分患者由于药物、病毒感染、肥胖、缺血等原因可继发FSGS样病变,与原发性FSGS机制不同。
在临床中,若微小病变肾病对激素治疗反应不佳时,需要警惕该患者是否为FSGS。可将患者肾活检标本继续连续切片,仔细寻找是否有节段硬化病变,若第一次肾活检肾小球数量较少,可考虑重复肾活检以明确病理类型。治疗方面,成人FSGS需足量激素治疗16周,若无效考虑为激素抵抗型FSGS,首选加用钙调素抑制剂治疗。本例患者临床符合难治性肾病综合征,第一次肾活检诊断微小病变肾病,但是肾小球数小于10个,在第二次肾活检中发现24个肾小球中13个存在节段硬化病变,故FSGS诊断成立。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系
[1] CHO M H,HONG E H,LEE T H,et al.Pathophysiology of minimal changenephritic syndrome and focal segmental glomerulosclerosis[J].Nephrology(Carlton),2007,12(Suppl 3):S11-S14.
[2] CLEMENT L C,AVILA-CASADOC,MACE C,etal.Podocyte-secretedangiopoietin-like-4mediatesproteinuriainglucocorticoid-sensitivenephroticsyndrome.NatMed,2011,17(1):117-122.
[3] WEI C, EL HINDI S, LI J, et al. Circulating urokinase receptor as acause of focal segmental glomerulosclerosis[J].Nat Med, 2011,17(8):952-960.
[4] ZHU L, JIANG R, AOUDJIT L, et al. Activation of RhoA in podocytesinduces focal segmental glomerulosclerosis[J].J Am SocNephrol,2011,22(9):1621-1630.
[5] D'AGATI V D, KASKEL F J, FALK RJ. Focal segmentalglomerulosclerosis[J].N Engl J Med,2011,365(25):2398-2411.
[6] VIVARELLI M, MASSELLA L, RUGGIERO B, et al. Minimal changedisease[J].Clin J Am Soc Nephrol,2017,12(2):332-345.
[7] FOGO A B.Causes and pathogenesis of focal segmentalglomerulosclerosis[J]. Nat Rev Nephrol,2015,11(2):76-87.





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
