美国食品和药物管理局(FDA)近日批准依库丽单抗(eculizumab)作为抗乙酰胆碱受体(AChR)抗体阳性的全身性重症肌无力(gMG)成年患者的治疗药物。相关的3期REGAIN研究结果发表在20日的《The Lancet Neurology》杂志上。
3期REGAIN研究的主要研究者、美国北卡罗来纳大学医学院神经肌肉疾病部主任James F. Howard博士介绍说,3期REGAIN研究帮助FDA批准该药物用于治疗这种慢性和衰弱性神经肌肉疾病。它是60多年来首例获FDA批准的gMG治疗方案。
他说,我很高兴FDA认可了此药治疗抗AchR抗体阳性gMG患者的综合临床数据。对接受现有疗法没有得到充分缓解的患者来说,现在将有一种新的治疗方案,以改善患者的症状,使他们能够开展日常生活,并提高他们的生活质量。
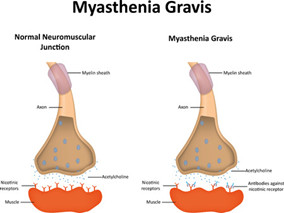
重症肌无力(MG)是一种衰弱、慢性、渐进的自身免疫性神经肌肉疾病,可以发生在任何年龄,但最常见于40岁以前的女性和60岁以上的男性。它通常从控制眼睛和眼睑运动的肌肉虚弱开始,并且经常进展到更严重和普遍的形式,也就是gMG,表现为头部、颈部、躯干、四肢和呼吸系统的肌肉虚弱。
虽然大多数gMG患者可以使用目前的MG治疗方法进行管理,但约5~10%的患者对那些免疫抑制治疗无应答或不耐受,并深受步行、说话、吞咽和呼吸困难在内的肌无力症状的困扰。除此之外,若疾病加重,他们可能需要住院和重症监护,并可能危及生命。3期REGAIN研究及其正在进行的开放性扩展研究证实依库丽单抗对这些患者具有治疗益处。
免疫系统一部分的补体系统是长期失控性激活,对那些抗AChR抗体阳性的gMG患者衰弱的症状和潜在危及生命的并发症起重要作用。选择性和有效地抑制末端补体级联,这是依库丽单抗靶向疾病的关键根本原因。
依库丽单抗曾被福布斯称为“世界上最昂贵的药物”,用于治疗阵发性夜间血红蛋白尿(PNH)、非典型溶血性尿毒症综合征(aHUS)等罕见病。早前,依库丽单抗已在欧盟和日本获得了治疗MG的孤儿药资格。此次,通过FDA扩展适应症批准,它将帮助更多患有gMG的美国患者减轻痛苦。
(环球医学编辑:石 岩)
免责声明
版权所有©北京诺默斯坦管理咨询有限公司。 本内容由环球医学独立编写,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.