52岁男性,因“发热、咳嗽、咳痰1周”入院,门诊化验提示感染血象,血沉和CRP均显著升高。此外,该患者原有结节病史,长期口服激素与免疫抑制剂治疗。该患者所患何病?如何诊治?
【病例简介】
患者男性,52岁。主因“发热、咳嗽、咳痰1周”入院。患者于2017年7月30日无明显诱因出现晨起发热、乏力,体温37.8℃;偶伴咳嗽、咳白痰;无寒战、头晕、头痛;每天11时后体温可自行下降至正常。2017年8月2日就诊于我院门诊,查体温37.6℃,血常规示:白细胞:10.74×109/L,中性粒细胞:90.8%,血沉:37mm/h,C反应蛋白:35.60mg/L。 门诊以肺部感染收入院。患病以来精神委靡,胃纳差,睡眠可,大小便正常,无明显体重下降。
入院查体:
T 37.6℃,P 98 次/min,R 18 次/min,BP 104/60mmHg。
神清,步入病房,查体合作。全身皮肤无溃烂,浅表淋巴结无肿大。巩膜无黄染。口唇无发绀,咽部无充血水肿,扁桃体无肿大。胸廓对称无畸形,胸骨无压痛;触觉语颤对称,未触及胸膜摩擦感;双肺叩诊呈清音;双肺呼吸音粗糙,可闻及少量干、湿性啰音,双下肺呼吸音低,未闻及胸膜摩擦音。心率98次/min,律齐,各瓣膜听诊区未闻及杂音;腹软,全腹无压痛,无肌紧张及反跳痛,肝脾肋下未触及,肝肾区无叩击痛,肠鸣音2次/min。关节无红肿,无杵状指(趾),双下肢无水肿。肌力、肌张力正常,生理反射存在,病理反射未引出。
既往史及个人史:
冠心病心脏支架植入术后6年余,未服用药物。2017年4月在我院诊断“肺结节病”,口服甲泼尼龙及硫唑嘌呤治疗至今已4个月余。吸烟20包年,戒烟2年余。否认疫水接触史,否认食物、药物过敏史,否认冶游史。
初步诊断:
1.肺部感染
2.肺结节病Ⅲ期
【病例解析】
问题1:如何明确肺部感染的诊断?
患者原有结节病史,长期口服激素与免疫抑制剂治疗。此次发病无明确诱因出现发热、咳嗽、咳痰1周,门诊化验提示感染血象,血沉和CRP均显著升高,综合病情特点,考虑肺部感染可能性大。入院后为明确诊断即刻完善以下检查。
辅助检查:
血常规(2017-08-04):白细胞:10.74×109/L,中性粒细胞:90.8%。
血沉:37mm/h。
C反应蛋白:35.60mg/L。
降钙素原:0.92ng/ml。
T-SPOT和呼吸道病原体IgM抗体九联检测:均阴性。
自身抗体系列:抗核抗体,ENA抗体谱,抗中性粒细胞胞浆抗体均为阴性。
动脉血气分析:pH:7.457,二氧化碳分压:4.03kPa,氧分压:6.54kPa,氧饱和度:86.8%。提示重度低氧血症。
胸部CT平扫(2017-08-07,图1A):两肺弥漫性磨玻璃影,以双肺上叶明显;双侧胸膜局限性增厚和胸膜下结节影,双侧胸腔积液。
胸腔积液检查(2017-08-10):胸腔积液常规提示渗出液;胸腔积液细菌涂片和培养均阴性;胸腔积液病理细胞学未见恶性肿瘤细胞。
根据2016年中国成人社区获得性肺炎(CAP)诊断和治疗指南:
1.社区发病。
2.肺炎相关临床表现 ①新近出现的咳嗽、咳痰或原有呼吸道疾病症状加重,伴或不伴脓痰/胸痛/呼吸困难/咯血;②发热;③肺实变体征和/或闻及湿性啰音;④外周血白细胞>10×109/L或<4×109/L,伴或不伴细胞核左移。
3.胸部影像学检查显示新出现的斑片状浸润影、叶/段实变影、磨玻璃影或间质性改变,伴或不伴胸腔积液。
符合1、3及2中任何1项,并除外肺结核、肺部肿瘤、非感染性肺间质性疾病、肺水肿、肺不张、肺栓塞、肺嗜酸性粒细胞浸润症及肺血管炎后,可建立临床诊断。
本例患者为社区发病,具有发热、咳嗽等临床症状,外周血白细胞>10×109/L,胸部CT提示新出现浸润影、磨玻璃影或间质性等改变(图1A)。PCT、血沉、CRP均有增高,社区获得性肺炎诊断明确。由于患者长期口服激素与免疫抑制剂治疗,结合胸部CT影像学特点,考虑免疫抑制所致机会致病菌感染可能性大。因此,初始治疗经验性抗感染药物的合理选择和尽快明确病原学诊断是患者成功治疗的关键。
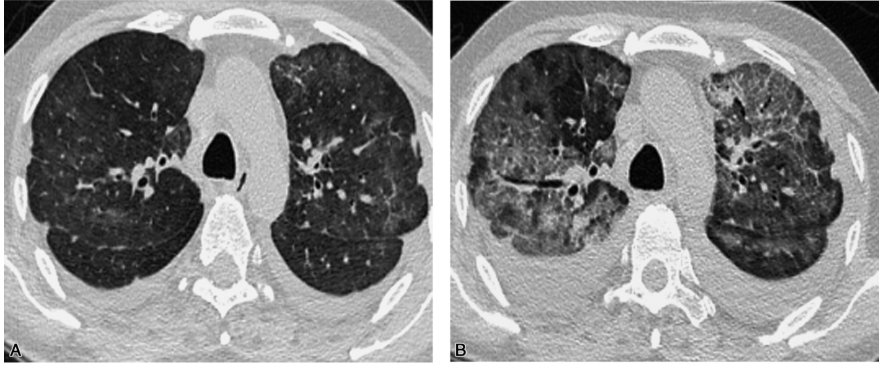
图1 胸部CT平扫
A.双肺上叶弥漫性磨玻璃影,双侧胸膜局限性增厚和胸膜下结节影,双侧少量胸腔积液(2017-08-07);B.经左氧氟沙星、更昔洛韦和伏立康治疗1周,双肺弥漫性磨玻璃样改变,部分实变,双侧胸腔积液(2017-08-21)
问题2:初始治疗如何合理选用经验性抗感染药物?
CAP致病原组成和耐药特性在不同国家、地区之间存在明显差异。目前肺炎支原体和肺炎链球菌是我国成人CAP的主要致病原。我国肺炎链球菌对大环内酯类药物的耐药率为63.2%~75.4%。对口服青霉素、二代头孢菌素、注射用青霉素和三代头孢菌素的耐药率分别为:24.5%~36.5%、39.9%~50.7%、1.9%和13.4%。肺炎支原体对大环内酯类药物的耐药率超过70%,但仍对喹诺酮类等抗菌药物敏感。此例患者有基础疾病肺结节病,长时间服用激素和硫唑嘌呤治疗,在免疫受损条件下,产ESBL肠杆菌、真菌和巨细胞病毒感染的可能性较大。综合我国CAP的病原学特点和该患者的临床特征,我们经验性予以左氧氟沙星联合美罗培南抗感染治疗,激素减量并停用硫唑嘌呤治疗;同时,采用多种方法积极明确患者的病原学诊断。
电子支气管镜检查:BALF常规送检未见明显异常,病原学涂片阴性。
BALF送检mNGS检测:提示可能致病菌:嗜麦芽寡养单胞菌。该菌为G-杆菌,是条件致病菌,多发生于有严重基础疾病患者。鉴于目前抗感染方案可覆盖该致病菌,抗生素用药方案未调整。
患者抗感染治疗1周后,仍有高热,体温最高可达40℃,一般状况明显恶化,并出现气喘等临床表现;血气分析提示重度低氧血症。综合疗效分析提示初始经验性抗感染治疗失败。
问题3:该患者肺部感染治疗效果不佳,原因是什么?应采取哪些针对性措施?
经多学科讨论(MDT)一致认为该患者肺部感染初始治疗失败。根据我国2016版CAP指南定义:初始治疗后患者症状无改善,需要更换抗感染药物,或初始治疗一度改善又恶化,病情进展,认为初始治疗失败。究其原因,主要为以下几点:第一,是否为诊断错误。前已述及,该患者肺部感染诊断明确。第二,病原体为耐药菌或现用抗感染药物未覆盖致病菌。第三,存在其他导致病情进展的合并症。此患者基础疾病为结节病,目前仍然口服甲泼尼龙治疗中,且胸部CT影像学不符合肺结节病进展表现。综合分析,应考虑特殊病原菌感染,现用抗感染药物未能覆盖。因此,我们再次行气管镜灌洗,BALF送检mNGS。
mNGS报告:烟曲霉和巨细胞病毒(CMV)阳性。
根据mNGS结果立即调整抗感染治疗方案:保留对初次检测出的嗜麦芽寡养单胞菌有效的抗生素左氧氟沙星,停用美罗培南,增加更昔洛韦抗病毒和伏立康唑治疗曲霉菌。为防止感染加重,甲泼尼龙逐渐减量。
在此三药联合的基础上,患者体温曾有短暂的下降趋势,然而1周后再次出现高热,最高达39.0℃,气促明显。2017年8月21日复查肺CT示双肺弥漫性磨玻璃样改变,较前明显加重(图1B)。 血气分析 pH:7.457,二氧化碳分压:4.03kPa,氧分压:6.54kPa,氧饱和度:86.8%,患者已出现Ⅰ型呼吸衰竭。至此,患者病情仍在不断进展中。
问题4:该患者病情进展原因仍是没有覆盖致病菌吗?
患者肺部感染诊断明确,多次予以针对性的强力、联合抗感染治疗。然而,无论是临床症状,还是肺部CT影像学上都明确提示肺部感染进展状态。鉴于该患者本次入院已行两次支气管镜检查,且目前病情危重难以耐受再次有创检查。为此,我们复习患者既往疾病资料,仔细阅读肺CT表现,总结患者病情特点如下:①患者肺部感染诊断明确,病情进展原因考虑目前使用药物没有覆盖致病原。②免疫受损患者,除细菌、曲霉菌、巨细胞病毒等病原体感染外,还可能有放线菌、肺结核、非结核分枝杆菌和肺孢子菌等感染的可能,需要临床进一步排查。③患者肺CT特点:双肺快速进展的弥漫性磨玻璃样改变,同时合并有网状改变、补丁样磨玻璃斑片影、多发肺气囊(图1B),这些征象高度提示肺孢子菌肺炎(PCP)。值得疑问的是,如果存在PCP,为何BALF送检mNGS未见此菌?为此我们联系检测公司了解肺孢子菌检测情况,获悉在当时国内病原NGS数据库尚无该菌。即刻对原mNGS检测结果进行PCP序列比对分析,明确肺孢子菌诊断。
【最终诊断】
1.重症肺炎(嗜麦芽窄食单胞菌、巨细胞病毒、烟曲霉、肺孢子菌肺部感染),Ⅰ型呼吸衰竭
2.肺结节病Ⅲ期
【治疗】
在原有药物基础上,加用复方磺胺甲??唑针对PCP,伏立康唑改用PCP更加敏感的卡铂芬净,兼顾曲霉菌和肺孢子菌;同时静脉使用甲泼尼龙促进肺部病灶吸收;加强营养支持、无创辅助通气。患者体温逐渐恢复正常,咳嗽、气喘等症状明显缓解。2017年9月25日复查肺CT示双肺弥漫性改变逐渐吸收(图2A)。
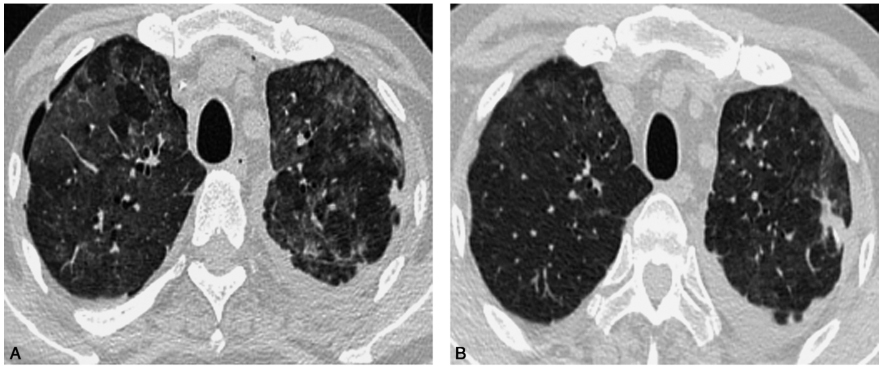
图2 患者联用抗肺孢子菌药物后病情好转,病灶逐渐吸收
A.复方磺胺甲??唑、卡泊芬净、左氧氟沙星和甲泼尼龙治疗半个月,复查胸部CT示双肺弥漫性磨玻璃样改变,胸膜下结节影,双侧胸腔积液较2017年8月21日显著改善;B.口服复方磺胺甲??唑、伏立康唑、左氧氟沙星和甲泼尼龙治疗3个月后复查胸部CT示左上肺胸膜下结节、条索影,双侧少量胸腔积液,提示病灶基本吸收消散
【随访】
患者出院后继续口服左氧氟沙星、伏立康唑和复方磺胺甲??唑抗感染治疗;甲泼尼龙20mg/d,口服治疗结节病。2018年1月17日复查肺CT示双肺弥漫性改变基本吸收消散(图2B)。
【病例点评】
1.继发性免疫缺陷患者肺部感染的常见致病菌
免疫缺陷分为原发性免疫缺陷和获得性免疫缺陷两大类。原发性免疫缺陷是免疫系统先天性发育不全所致。继发性免疫缺陷除人类免疫缺陷病毒(HIV)感染所致的AIDS外,常见于营养不良、肿瘤、器官移植、长期口服激素和免疫抑制剂等患者。继发性免疫缺陷患者的肺部机会性感染病原体主要有非发酵菌、疱疹病毒科的巨细胞病毒、结核与非结核分枝杆菌、真菌(常见曲霉菌、肺孢子菌)和弓形虫等。本例患者初诊为肺结节病,长期口服糖皮质激素和硫唑嘌呤,因此该患者属于继发性免疫缺陷。经过常规病原学检测手段和mNGS检测最终确诊患者为多种病原菌导致的重症肺炎,致病菌包括:嗜麦芽窄食单胞菌、巨细胞病毒、烟曲霉、肺孢子菌,几乎涵盖了继发性免疫缺陷患者所有常见致病菌。此例患者的临床经过提示我们对于长期口服激素和免疫抑制剂的继发性免疫缺陷患者,初始抗感染治疗应强力和广覆盖,尤其注意覆盖肺孢子菌感染。
2.PCP肺炎的发病机制与影像学特点
PCP的发病机制及病理基础是卡氏肺孢子菌的滋养体破坏Ⅰ型肺泡上皮细胞膜,使细胞坏死及毛细血管通透性增加,肺泡内充盈含有滋养体的嗜酸性渗出物、纤维蛋白和脱落的上皮细胞。同时Ⅱ型肺泡上皮细胞增殖,修复受损的肺泡毛细血管膜,肺间质内巨噬细胞、浆细胞和淋巴细胞增殖导致间质改变。PCP的影像学表现为:实变及磨玻璃影、小叶间隔增厚、支气管血管束周围间质增厚、小叶内间质增生、胸膜下间质增生、牵拉性支气管扩张、肺气囊、马赛克表现、碎石路征和纵隔淋巴结增大等。此例患者胸部CT影像学表现为对称性双上肺始发的弥漫性磨玻璃影,小叶间隔增厚、支气管血管束周围间质增厚、小叶内间质增生,且有肺气囊、补丁样磨玻璃改变等较为特征性病变。因此,我们临床疑诊PCP,并最终通过mNGS检测确诊。综上所述,继发性免疫缺陷患者近期出现肺部感染,HRCT扫描出现上述间质性改变、对称性磨玻璃影、新发肺气囊及马赛克表现时应高度警惕PCP。早期诊断可显著改善患者预后。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]PECKHAM D,ELLIOTT M W.Pulmonary infiltrates in the immunocompromised:diagnosis management[J].Thorax,2002,57 (Suppl 2):II3-II7.
[2]LANGELIER C,KALANTAR K L,MOAZED F,et al.Integrating host response and unbiased microbe detection for lower respiratory tract infection diagnosis in critically ill adults[J].Proc Natl Acad Sci USA,2018,115(52):E12353-E12362.
[3]张艳,陈平.继发性免疫缺陷患者肺部机会性感染的诊治及其预防[J].临床内科杂志,2009,26(4):221-223.
[4]杨诚,蒋瑾,路涛.卡氏肺孢子菌肺炎的高分辨CT表现[J].实用医院临床杂志,2016,13(1):44-45.
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.