前列腺癌骨转移的治疗主要包括两个方面,分别为针对前列腺癌原发灶的治疗和针对骨转移灶的治疗。针对前列腺癌原发灶的治疗方法主要包括手术、放疗、内分泌治疗、化疗、免疫治疗以及射频消融治疗等;针对骨转移灶的治疗方法包括骨改良药物治疗、放射性药物治疗、生活方式调整、对症止痛治疗等。本文聚焦于前列腺癌骨转移相关的合理化用药,因此,不对手术、放疗及射频消融等外科或局部治疗方法进行详细介绍,将主要对前列腺癌全身治疗和前列腺癌骨转移的治疗进行分析,并提出合理化用药指导。
一、前列腺癌的全身治疗
1.内分泌治疗
内分泌治疗是前列腺癌最常用的治疗方法之一,也是晚期前列腺癌的一线治疗方法,能显著延长患者的无进展生存期和总生存期。方法主要包括去势治疗、单一抗雄激素治疗、雄激素完全阻断治疗、雄激素生物合成抑制剂治疗、根治性治疗前新辅助内分泌治疗、间歇内分泌治疗和根治性治疗后辅助内分泌治疗等。内分泌治疗可分为一线和二线内分泌治疗,其中一线内分泌治疗方式主要有去势治疗、单独抗雄激素药物治疗和雄激素完全阻断治疗。
(1)去势治疗(ADT)
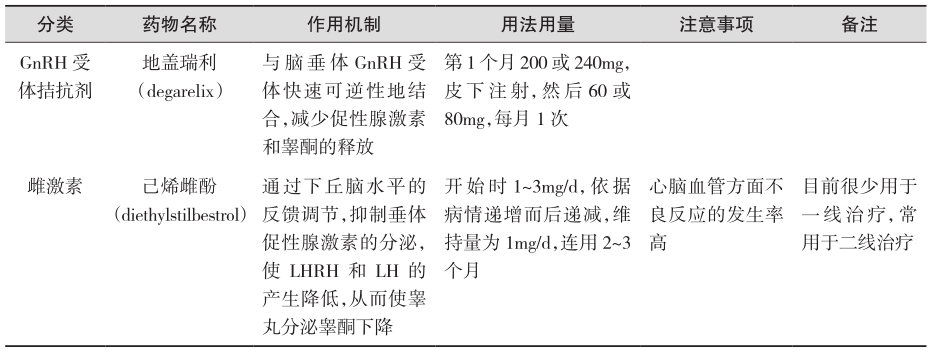
可抑制雄激素生成,降低体内的雌激素水平,去除雄激素对前列腺癌细胞生长的刺激作用。主要方法包括手术去势(双侧睾丸切除术)和药物去势(LHRH类似物、雌激素),适用范围是:①转移性前列腺癌;②局限早期前列腺癌或局部进展前列腺癌,无法行根治性前列腺切除术或放疗;③根治性前列腺切除术或根治性放疗前的新辅助内分泌治疗;④配合放疗的辅助内分泌治疗;⑤治愈性治疗后局部复发、转移;⑥雄激素非依赖期的雄激素持续抑制。具体药物及用法用量见表1(证据级别:Ⅰ;推荐级别:A)。
表1 去势治疗
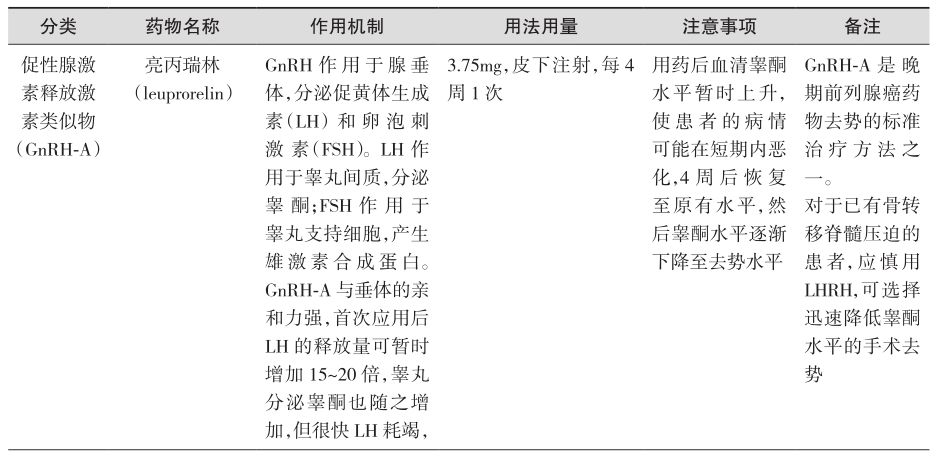
续表

续表
(2)抗雄激素治疗(AAM)
可与内源性雄激素在靶器官上竞争受体结合,在胞质内通过与二氢睾酮受体结合,抑制二氢睾酮进入细胞核,从而阻断雄激素对前列腺癌细胞的作用,主要适用于局部晚期且无远处转移的前列腺癌,即分期为T3~4NxM0。根据化学结构不同,可分为类固醇和非类固醇两类。具体药物及用法用量见表2(证据级别:Ⅰ;推荐级别:A)。
表2 抗雄激素治疗
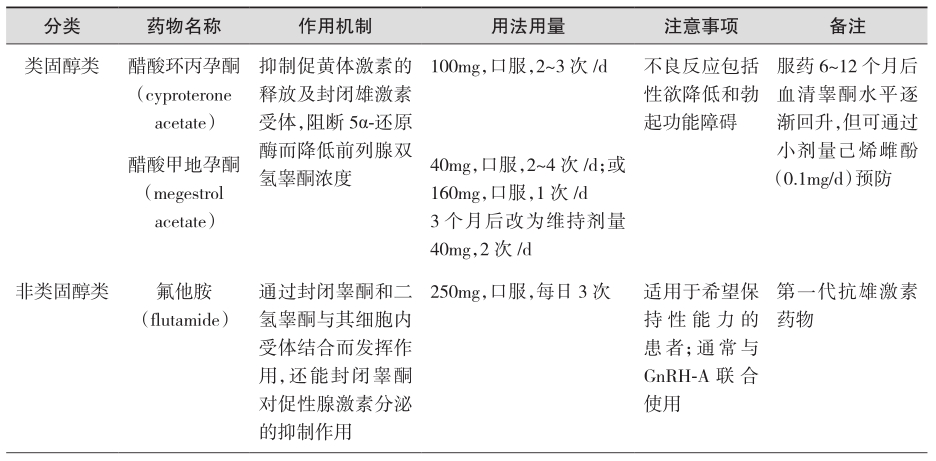
续表
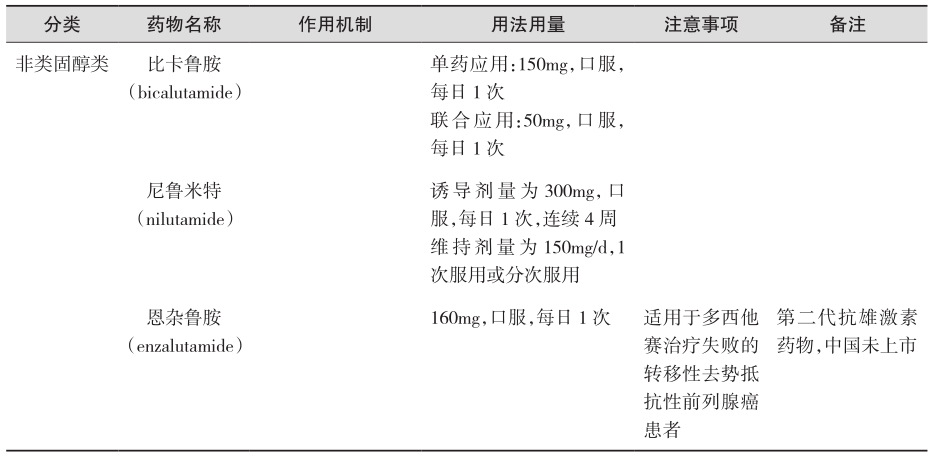
(3)雄激素生物合成抑制剂治疗
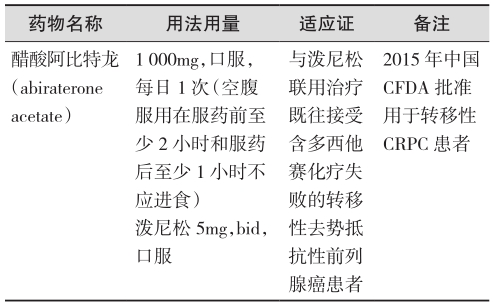
醋酸阿比特龙可通过抑制雄激素合成途径的关键酶CYP17,从而抑制睾丸、肾上腺和前列腺癌细胞的雄激素合成,适用于无症状或轻微症状的转移性去势抵抗性前列腺癌(mCRPC),或不适合化疗的症状性mCRPC患者的一线治疗,以及化疗后有病情进展的mCRPC患者的一线治疗。在COU-AA-301研究中,对于多西他赛化疗后病情进展的mCRPC患者,醋酸阿比特龙联合泼尼松组的中位生存期为15.8个月,相比对照组延长了4.6个月,死亡风险降低了26%。在COU-AA-302研究终期分析中,对于无症状或轻微症状的mCRPC患者,醋酸阿比特龙联合泼尼松组和对照组的中位生存期为34.7和30.3个月,治疗组将中位生存期延长了4.4个月,死亡风险降低了19%。具体药物及用法用量见表3(证据级别:Ⅰ;推荐级别:A)。
表3 雄激素生物合成抑制剂治疗
(4)雄激素完全阻断治疗(CAB)
又称为最大雄激素阻断(MAB),去势治疗和抗雄激素药物治疗联合应用,可同时去除睾丸来源和肾上腺来源的雄激素。PCTCG荟萃分析和日本的随机对照双盲多中心Ⅲ期临床研究均显示,LHRHa联合比卡鲁胺抗雄激素药物的CAB治疗方案较单纯LHRHa去势治疗能不同程度地降低晚期前列腺癌患者的死亡风险、延长其无进展生存期。近年来,美国NCCN指南和欧洲EAU指南认为比卡鲁胺联合去势治疗能改善5%~20%患者的总生存期(证据级别:Ⅰ;推荐级别:A)。
(5)根治性治疗前新辅助内分泌治疗(NHT)
适用于T2、T3a期。方法是LHRH类似物联合抗雄激素药物的CAB,也可单用LHRH类似物或抗雄激素药物,但联合CAB的疗效更佳。新辅助治疗的时间为3~9个月(证据级别:Ⅱ;推荐级别:B)。
(6)间歇内分泌治疗(IHT)
可延长肿瘤进展到激素非依赖期的时间,适用于无法行根治性手术或放疗的局限前列腺癌、局部晚期患者(T3~T4期)、转移前列腺癌、病理切缘阳性、根治术或局部放疗后复发。多采用CAB方法,也可用药物去势。国内推荐停药标准为PSA,也可用药物去势后,持续3~6个月。国内推荐当PSA>4ng/ml,开始新一轮治疗(证据级别:Ⅱ;推荐级别:B)。
(7)根治性治疗后辅助内分泌治疗
目的是治疗切缘残余病灶、残余的阳性淋巴结、微小转移病灶等。适应证包括根治术后病理切缘阳性、术后病理淋巴结阳性、病理分期为T3期或≤T2期但伴高危因素(Gleason评分>7分,PSA>20ng/ml)、局部晚期前列腺癌根治性放疗后。方法包括CAB、药物或手术去势、抗雄激素治疗。建议术后或放疗后即刻开始,最短时间应为18个月(证据级别:Ⅱ;推荐级别:A)。
(8)抗雄激素撤退治疗
接受抗雄激素治疗的患者,雄激素受体基因可能发生突变,导致受体的特异性降低,抗雄激素药物反而作为激动剂激活下游通路,最终导致治疗失败。此时如停用抗激素药物,约1/4的患者可出现3~5个月的PSA下降和病灶改善(证据级别:Ⅱ;推荐级别:B)。
2.化学治疗
化疗是转移性去势抵抗性前列腺癌(CRPC)的重要治疗手段,常用药物包括紫杉类、米托蒽醌、多柔比星、表柔比星、雌莫司汀、环磷酰胺、去甲长春地辛、顺铂和氟尿嘧啶。紫杉类现已成为转移性前列腺癌内分泌治疗失败的标准一线化疗药物。然而,晚期前列腺癌单药化疗效果不佳,目前推荐联合用药方案,具体化疗药物及方案见表4。
表4 晚期前列腺癌的化疗方案

续表

3.免疫治疗
Sipuleucel-T是目前唯一应用于前列腺癌临床治疗的自身肿瘤疫苗,主要适应证是无症状或轻微症状、无肝转移、预期寿命>6个月、一般情况良好的CRPC患者。制备过程是首先从患者体内分离出抗原呈递细胞,在体外进行扩增并在前列腺酸性磷酸酶(PAP)中孵育活化,然后回输至患者体内,诱导产生针对前列腺癌的特异性免疫反应而达到治疗肿瘤的目的。在Ⅲ期临床研究中,人们发现与安慰剂相比,Sipuleucel-T可延长CRPC患者约4个月的生存时间,3年生存率为31.7%。但不推荐用于疾病进展迅速、有肝转移灶或预期生存期<6个月的患者(证据级别:Ⅱ;推荐级别:B)。
二、前列腺癌骨转移的治疗
目前,在临床上以前列腺癌骨转移灶为靶点的药物主要是骨改良药物和放射性药物,其中骨改良药物(bone-modifying agents,BMAs)包括双膦酸盐类药物和地诺单抗,而放射性药物包括释放β粒子的锶(strontium-89,89Sr)和钐(samarium-153,153Sm),以及释放α粒子的镭(radium-223,223Ra)。
1.骨改良药物
(1)双膦酸盐(bisphosphonates,BPs)类药物
BPs是预防和治疗骨转移相关并发症最常用的药物,具体分类及用法用量见表5。BPs可降低或延迟骨转移的发生率,推荐一旦经放射线技术诊断为骨转移应尽快开始治疗,甚至是无症状的患者(证据级别:Ⅰ;推荐级别:A)。
表5 双膦酸盐类药物

续表

(2)地诺单抗(denosumab,D-mab)
地诺单抗是一种特异性NF-κB受体激活蛋白配体(RANKL)的完全性人单克隆抗体,能够抑制破骨细胞活化,减少骨吸收和肿瘤相关性骨破坏,可能具有打破由骨转移和破骨细胞活化引起的恶性循环的作用,适用于转移性去势抵抗性前列腺癌伴骨转移的患者。Fizazi等研究证实在CRPC骨转移患者中地诺单抗预防SREs优于唑来膦酸。他们发现,与唑来膦酸相比,地诺单抗可延迟首次发生SREs的时间,其中位数分别为17.1和20.7个月(P=0.008)。另一项Ⅲ期临床研究显示,地诺单抗可通过改变骨微环境而延缓前列腺癌发生骨转移。结果显示,与安慰剂相比,地诺单抗延长了无骨转移生存时间4.3个月(25.2个月vs 29.5个月,P=0.028),但两组患者的总生存期相似(43.9个月vs 44.8个月,P=0.91),而地诺单抗组发生下颌骨坏死及低钙血症的风险均高于安慰剂组。此外,Smith MR等在对非转移性CRPC人群的研究中发现,短期内PSA倍增的患者是出现骨转移的高危人群,地诺单抗可持续性改善PSA倍增患者的无骨转移生存期(BMFS),特别是对于可疑疾病进展的高危患者效果最佳。目前,地诺单抗暂未在中国上市。
基于上述研究结果,推荐唑来膦酸和地诺单抗均可用于出现骨转移的CRPC患者,并可以预防骨相关事件的发生(证据级别:Ⅱ;推荐级别:A)。唑来膦酸和地诺单抗的临床应用需根据患者的肾功能情况进行调整,具体方法见图1。唑来膦酸和地诺单抗治疗骨质疏松症和骨转移的推荐剂量见表6。
表6 唑来膦酸和地诺单抗治疗骨质疏松症和骨转移的推荐剂量
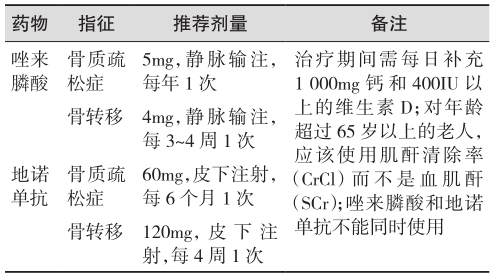
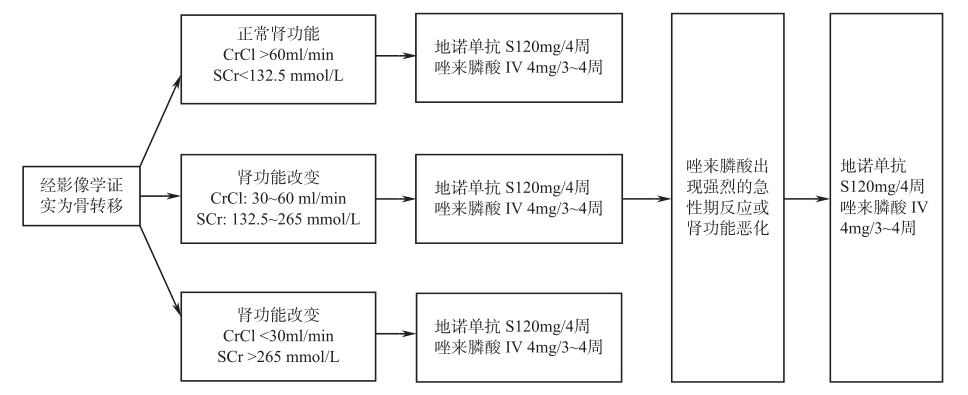
图1 骨转移患者应用双膦酸盐类药物治疗的流程图
2.放射性药物
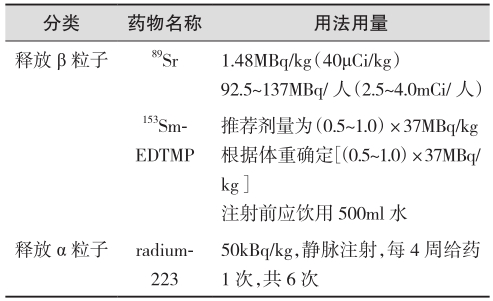
(1)释放β粒子的89Sr和153Sm
核素治疗是前列腺癌骨转移的一种有效减轻疼痛、改善症状的治疗手段。89Sr和153Sm主要应用于治疗成骨性骨转移,两者治疗前列腺癌骨转移所致的疼痛疗效相似,为60%~80%,但在疼痛缓解时间、不良反应、重复应用的时间间隔等方面略有不同。89Sr能聚集在有活性成骨组织的骨转移灶内,是一种有效的骨肿瘤的内照射治疗剂。治疗作用主要是利用所发射的β射线杀死癌细胞,进而达到镇痛效果。89Sr所发射的纯β射线的能量为1.46MeV,半衰期为50.5天。在注射后可快速被骨摄取,在正常骨内的生物半衰期为14天,在骨转移灶内的生物半衰期>50天。153Sm是一种放射性核素,由中子轰击浓缩的钐(152Sm)氧化物而来,用于患有成骨性骨转移、核素骨扫描显示有放射性浓聚灶的患者的疼痛治疗。153Sm可同时发射β和γ射线。153Sm的趋骨性极低,其与乙二胺四亚甲基膦酸(EDTMP)螯合后形成的新复合物153Sm-EDTMP具有较高的趋骨性。在骨转移灶中153Sm-EDTMP的浓度是正常骨组织的5倍,使得肿瘤细胞可持续暴露于较高辐射剂量的β射线下达到局部治疗的目的。核素治疗最常见的不良反应为骨髓抑制。
(2)释放α粒子的radium-223
radium-223是一种α粒子辐射放射性治疗药物,其活性部分模拟了钙离子,通过与骨骼中的羟基磷灰石(HAP)形成复合物,选择性地靶向骨骼,尤其是骨转移区域。ALSYMPCA研究结果显示,与安慰剂相比,radium-223治疗组患者的中位OS延长了3.6个月(14.9个月vs.11.3个月,P=0.000 07),死亡风险降低30.5%,至首次SREs的时间延迟5.8个月(15.6个月vs.9.8个月,P<0.000 1)。亚组分层提示,无论患者是否接受过多西他赛化疗或是否接受过双膦酸盐治疗,均可从radium-223治疗中获益。推荐radium-223用于治疗晚期伴骨转移的CRPC患者(证据级别:Ⅱ;推荐级别:A)。前列腺癌骨转移的相关放射性药物具体见表7。
表7 前列腺癌骨转移的相关放射性药物
3.其他治疗方法
(1)生活方式调整
1)饮食方面
对无高钙血症的患者建议进食高钙食物(如乳品、绿叶蔬菜)或补充钙剂,每日钙摄入量约1200mg。在补钙的同时,建议通过每天日晒15~30分钟、进食富含维生素D的食物(如富含脂类的鱼、油、肝脏、强化乳品和谷类)补充每日维生素D的摄入量或补充维生素D(400~800IU/d)。
2)加强锻炼
可根据健康状态和年龄选择适当的负重性体力锻炼,以增强骨骼和肌肉的强度。
3)改变不良生活习惯
如戒烟、降低饮酒量、避免咖啡因摄入。
(2)止痛药物治疗
止痛药物治疗是缓解前列腺癌骨转移疼痛的主要方法之一。止痛药物治疗应遵循WHO癌痛治疗的基本原则进行。首选口服及无创给药途径,依照阶梯给药、按时给药和个体化给药原则,同时注意具体用药细节。
(3)多学科协作诊疗(MDT)
目前对于前列腺癌骨转移的治疗推荐进行MDT,MDT需要泌尿外科、肿瘤科、放疗科、骨外科、病理科、放射诊断科和姑息性治疗等领域的专家共同参与,最终为前列腺癌骨转移患者的临床诊治提供准确的指导意见。
中国人民解放军北部战区总医院肿瘤科副主任医师,医学博士,中国抗癌协会肿瘤标志专委会CTC技术专家委员会委员,中国抗癌协会肿瘤标志专委会肿瘤标志物临床转化研究协作组委员,中国抗癌协会中西医整合肿瘤专委会青年委员,辽宁省细胞生物学学会肿瘤心脏病与细胞学专委会副主任委员,辽宁省中医药学会淋巴水肿综合治疗专委会副秘书长,辽宁省生命科学学会泌尿生殖肿瘤诊治与康复专委会委员,辽宁省中西医结合学会肿瘤学专委会委员。擅长呼吸系统、泌尿系统恶性肿瘤的内科综合诊治,在病因筛查及发病风险预测等研究领域具有较深造诣。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2017[J].CA Cancer J Clin,2017,67(1):7-30.
[2]GILLESSEN S,ATTARD G,BEER T M,et al.Management of patients with advanced prostate cancer:the report of the advanced prostate cancer consensus conference APCCC 2017[J].EurUrol,2018,73(2):178-211.
[3]CHEN W,ZHENG R,ZHANG S,et al.Cancer incidence and mortality in China in 2013:an analysis based on urbanization level[J].Chin J Cancer Res,2017,29(1):1-10.
[4]NANDANA S,TRIPATHI M,DUAN P,et al.Bone Metastasis of prostate cancer can be therapeutically targeted at the TBX2-WNT signaling axis[J].Cancer Res,2017,77(6):1331-1344.
[5]SHIBATA H,KATO S,SEKINE I,et al.Diagnosis and treatment of bone metastasis:comprehensive guideline of the Japanese Society of Medical Oncology,Japanese Orthopedic Association,Japanese Urological Association,and Japanese Society for Radiation Oncology[J].ESMO Open,2016,1(2):e000037.
[6]CASSINELLO ESPINOSA J,GONZÁLEZ DEL ALBA BAAMONDE A,RIVERA HERRERO F,et al.SEOM guidelines for the treatment of bone metastases from solid tumours[J].Clin Transl Oncol,2012,14(7):505-511.
[7]COLEMAN R,BODY J J,AAPRO M,et al.Bone health in cancer patients:ESMO Clinical Practice Guidelines[J].Ann Oncol,2014,25(Suppl 3):124-137.
[8]ALIBHAI SMH,ZUKOTYNSKI K,WALKER-DILKS C,et al.Bone health and bone-targeted therapies for prostate cancer:a programme in evidence-based care-cancer care ontario clinical practice guideline[J].Clin Oncol(R Coll Radiol),2017,29(6):348-355.
[9]MORRISSEY C,ROUDIER M P,DOWELL A,et al.Effects of androgen deprivation therapy and bisphosphonate treatment on bone in patients with metastatic castration-resistant prostate cancer:results from the University of Washington Rapid Autopsy Series[J].J Bone Miner Res,2013,28(2):333-340.
[10]YAHARA J,NOGUCHI M,NODA S.Quantitative evaluation of bone metastases in patients with advanced prostate cancer during systemic treatment[J].BJU Int,2003,92(4):379-383.
[11]GÉCZI L,SINKOVICS I.Bone-targeted treatment in prostate cancer[J].MagyOnkol,2014,58(3):199-203.
[12]殷昭阳,施明,高江平.前列腺癌骨转移信号通路的研究进展[J].解放军医学院学报,2017,38(3):239-241.
[13]ATTARD G,PARKER C,EELES R A,et al.Prostate cancer[J].Lancet,2015,387(10013):70-82.
[14]中国抗癌协会癌症康复与姑息治疗专业委员会(CRPC),中国抗癌协会临床肿瘤学协作专业委员会(CSCO).恶性肿瘤骨转移及骨相关疾病临床诊疗专家共识(2014版)[J].北京:北京大学医学出版社,2014.
[15]宋乐,袁慧书,张卫方.前列腺癌骨转移18F-FDG PET/CT临床应用分析[J].临床放射学杂志,2016,35(5):768-771.
[16]WEI R J,LI T Y,YANG X C,et al.Serum levels of PSA,ALP,ICTP,and BSP in prostate cancer patients and the significance of ROC curve in the diagnosis of prostate cancer bone metastases[J].Genet Mol Res,2016,15(2):1-9.
[17]那彦群,叶章群,孙颖浩,等.中国泌尿外科疾病诊断治疗指南手册:2014版[M].北京:人民卫生出版社,2014.
[18]陈振东,王雅杰,唐金海,等.肿瘤综合治疗学[M].合肥:安徽科学技术出版社,2015.
[19]FIZAZI K,SCHER H I,MOLINA A,et al.Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer:final overall survival analysis of the COUAA-301 randomised,double-blind,placebo-controlled phase 3 study[J].Lancet Oncol,2012,13(10):983-992.
[20]RYAN C J,SMITH M R,FIZAZI K,et al.Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer(COU-AA-302):final overall survival analysis of a randomised,double-blind,placebo-controlled phase 3 study[J].Lancet Oncol,2015,16(2):152-160.
[21]IIDA K.Monotherapy versus combined androgen blockade for advanced/metastatic prostate cancer[J].Gan To Kagaku Ryoho,2011,38(13):2553-2557.
[22]KELLY W K,SCHER H I.Prostate specific antigen decline after antiandrogen withdrawal:the flutamide withdrawal syndrome[J].J Urol,1993,149(3):607-609.
[23]TANNOCK I F,DE WIT R,BERRY W R,et al.Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer[J].N Engl J Med,2004,351(15):1502-1512.
[24]NDIBE C,WANG C G,SONPAVDE G.Corticosteroids in the management of prostate cancer:a critical review[J].Curr Treat Options Oncol,2015,16(2):6.
[25]DE BONO J S,OUDARD S,OZGUROGLU M,et al.Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment:a randomised open-label trial[J].Lancet,2010,376(9747):1147-1154.
[26]OUDARD S,FIZAZI K,SENGELØV L,et al.Cabazitaxel versus docetaxel as first-line therapy for patients with metastatic castration-resistant prostate cancer:a randomized phase Ⅲ trial-FIRSTANA[J].J Clin Oncol,2017,35(28):3189-3197.
[27]石远凯,孙燕.临床肿瘤内科手册[M].北京:人民卫生出版社,2015.
[28]FIZAZI K,CARDUCCI M,SMITH M,et al.Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer:a randomised,double-blind study[J].Lancet,2011,377(9768):813-822.
[29]SMITH M R,SAAD F,COLEMAN R,et al.Denosumab and bone-metastasis-free survival in men with castration-resistant prostate cancer:results of a phase 3,randomised,placebocontrolled trial[J].Lancet,2012,379(9810):39-46.
[30]SMITH M R,SAAD F,OUDARD S,et al.Denosumab and bone metastasis-free survival in men with nonmetastatic castration-resistant prostate cancer:exploratory analyses by baseline prostate-specific antigen doubling time[J].J Clin Oncol,2013,31(30):3800-3806.
[31]HOSKIN P,SARTOR O,O’SULLIVAN J M,et al.Efficacy and safety of radium-223 dichloride in patients with castration-resistant prostate cancer and symptomatic bone metastases,with or without previous docetaxel use:a prespecified subgroup analysis from the randomised,doubleblind,phase 3 ALSYMPCA trial[J].Lancet Oncol,2014,15(12):1397-1406.
人卫知识数字服务体系





 Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
