目前,以外科手术切除为主的综合治疗方案是肝癌治疗的共识。1958年,武汉医学院第二附属医院(现为华中科技大学同济医学院附属同济医院)在国内首次报告肝切除术治疗肝癌,标志着我国手术治疗肝癌的开始。随着肝脏外科技术的不断进步,越来越多的病人可以从手术切除中获益。华中科技大学同济医学院附属同济医院牵头依托中华医学会肝脏外科学组组织全国112家医疗机构,统计了全国42573例肝切除病例的流行病学资料,其中67%为肝细胞癌病人(图1),结果表明我国肝癌肝切除术后总体生存时间为631天,3年和5年总体生存率为28.8%和19.6%(图2)。近十年,在广大肝脏外科医生的共同努力下,中国肝癌外科治疗技术取得了一系列非常瞩目的成就。
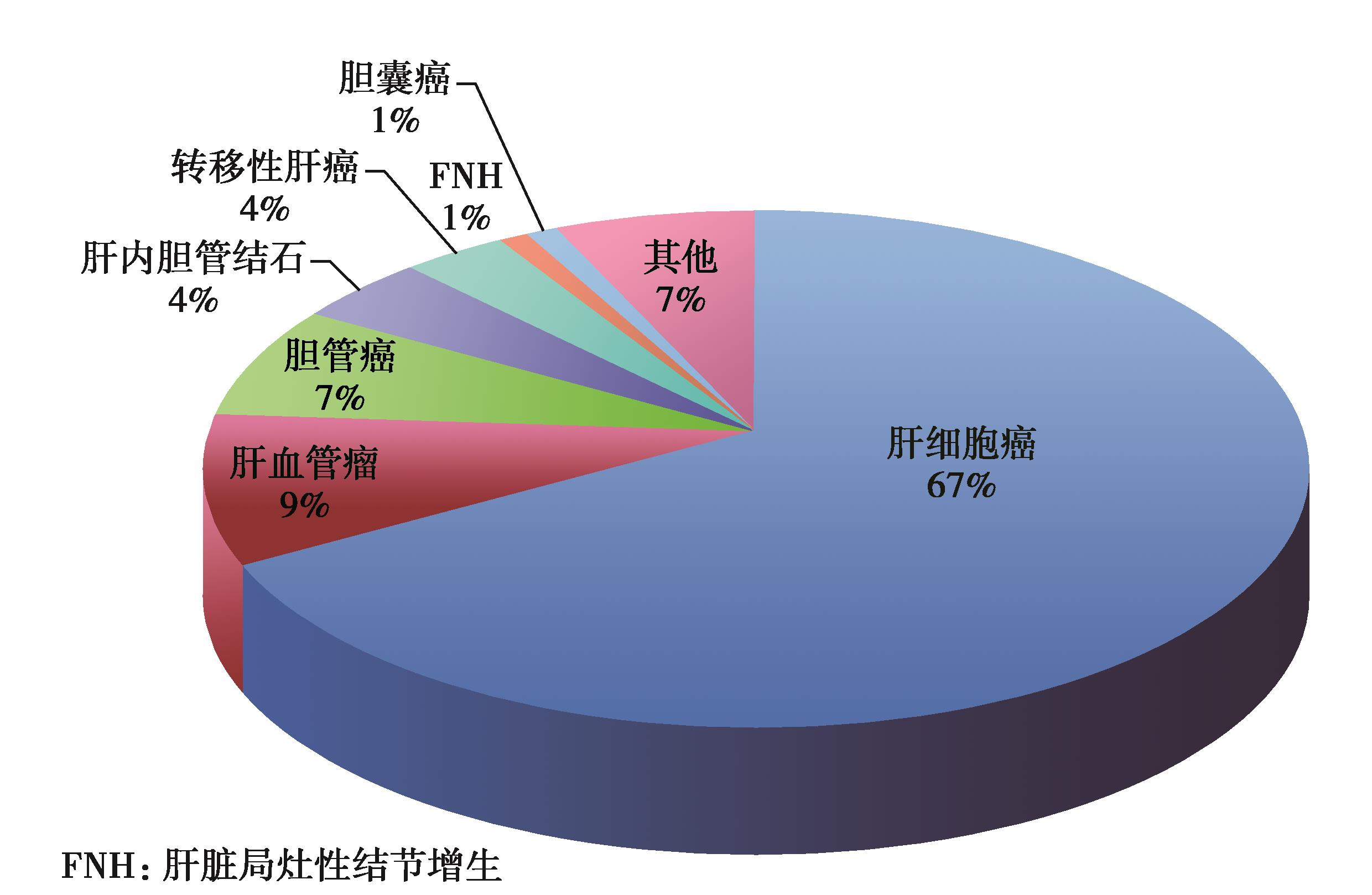
图1 全国多中心42573例肝切除病例的病种分布
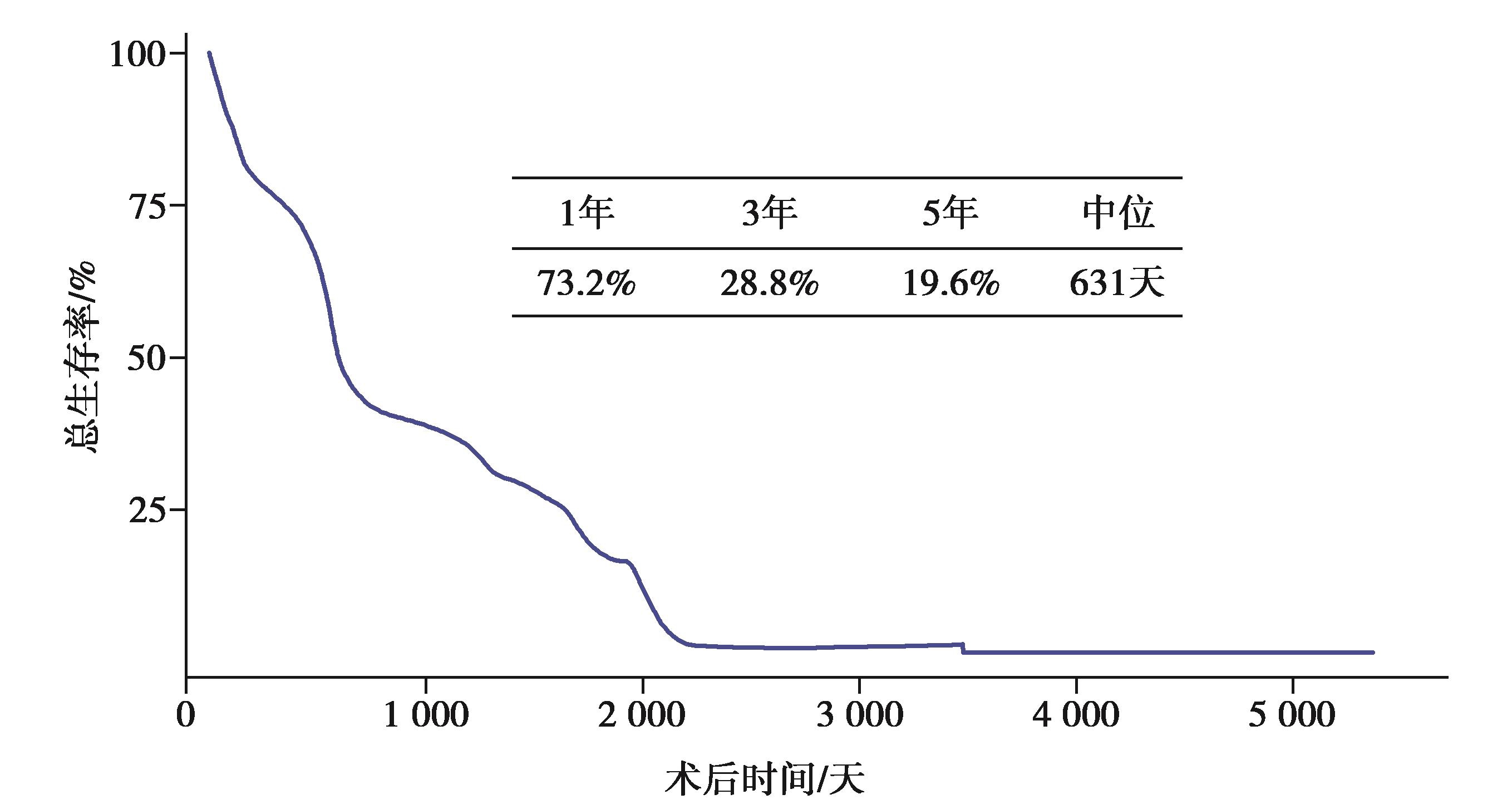
图2 全国多中心18275例肝细胞癌病人总体生存情况
一、术前评估精确化
在临床实践中,充分、精确的术前评估是病人安全的保证,既保证能根治性切除肿瘤,又能保证足够的剩余肝脏功能。汇集全国多中心肝脏储备功能评估经验,《肝切除术前肝脏储备功能评估的专家共识(2011版)》指出,术前精确评估肝脏储备功能,对于选择合理的治疗方法,把握安全的肝切除范围,降低病人术后肝功能衰竭发生率有重要意义。目前最常用的肝功能评分系统仍是Child-Pugh改良分级评分(表1);吲哚菁绿(ICG)排泄试验作为一种定量评估肝脏储备功能较为准确的方法,在全国多个中心得到越来越广泛应用。
表1 Child-Pugh改良分级评分

注:A级为5~6分;B级为7~9分;C级为10~15分。
近些年,由于影像学检查手段的不断进步,通过超声、电子计算机断层扫描(computed tomography,CT)和磁共振成像(magnetic resonance imaging,MRI),我们可以更精确地确定病变范围及其与肝内重要管道结构的毗邻关系,从而更好地确定手术等治疗方案。随着数字医学的进步,我们可以通过二维影像数据重建三维可视化模型,甚至进行虚拟现实重建。《肝细胞癌外科治疗方法的选择专家共识(2016年第3次修订)》《肝切除术围手术期管理专家共识》《原发性肝癌诊疗规范(2019年版)》《精准肝切除术专家共识》等均明确指出:三维可视化技术可以清晰显示肝内病灶与脉管系统的空间结构,借助于肝脏透明化和局部放大技术,更好地进行术前手术规划。而且三维重建得出的肝脏体积立体定量评估,可以精确掌握术后预留肝脏体积,极大程度上保证了病人的安全。
关于术前病人评估的具体临床实践,国内外各肝胆外科中心的经验和认知有不同。目前华中科技大学同济医学院附属同济医院临床实践的标准是,对于术前Child-Pugh改良分级评分要求<7分;如果行大范围肝切除,ICGR15应<10%;对于肝切除术后剩余肝脏体积,我们一般要求剩余肝脏重量需保证在体质量的1%以上。这些精确的术前评估使目前国内一些较大肝脏外科中心的肝切除术后并发症大大降低,死亡率低于1%。最近一项140例机器人肝切除病例统计显示,79例肝癌病人围手术期死亡率是0,Clavien-Dindo3、4级并发症发生率为8.6%。因此,通过上述详细术前量化评估,病人的手术安全性得到了有力的保障。
二、肝切除技术微创化
近十年,随着外科技术的进步,腹腔镜技术在肝切除方面亦得到了长足的发展。2015年,对2008—2013年27个肝脏外科中心共3765例腹腔镜肝切除的调查显示,其中肝细胞癌超过1640例,占43.6%。目前国内一些较大肝脏外科中心,腹腔镜肝切除治疗肝癌均已累计超过千例。
现有证据表明,腹腔镜肝切除治疗肝癌具有切口小、术中出血量少、术后胃肠道功能恢复较快、平均住院时间短和整体恢复较快的优点。Parks和Cheung等大样本回顾性研究显示,腹腔镜肝切除治疗肝癌的长期生存获益基本与开放肝切除相当。我国郑树国教授团队的前瞻性队列研究表明:腹腔镜肝切除治疗肝癌1、3年总体生存率为94.4%和81.4%,而开放组为93.6%和82.2%,差异无统计学意义。
当然,手术适应证选择和学习曲线也是腹腔镜肝切除治疗肝癌临床实践中不容忽视的问题。因此,腹腔镜肝切除国际会议形成的盛冈共识提出,腹腔镜下小范围肝切除可成为一种标准术式,大范围肝切除术的可行性及安全性值得进一步探索,对于一些难以耐受气腹者、腹腔内致密粘连、病变紧贴或直接侵犯大血管者、病变影响第一肝门和第二肝门显露和分离,无法在腹腔镜下安全操作或肝门部受侵犯以及存在门静脉癌栓等情况,是否行腹腔镜肝切除术,需临床医生慎重决策。2016年,肝细胞癌腹腔镜肝切除术的亚太共识亦持类似态度,除确实有出血少等优势外,腹腔镜肝切除治疗肝癌对于小范围肝切除包括左外叶切除应该是首选的。而且对于周边部位小肝癌,腹腔镜肝切除肿瘤学疗效明显优于射频消融治疗,因此值得推荐。但是对于超过3个肝段的大范围肝切除,由于技术门槛问题,仅推荐在少数经验丰富的腹腔镜中心进行。
最近十年,随着达芬奇机器人系统逐步进入中国大陆地区,越来越多的单位也开始尝试将机器人肝切除应用于治疗肝癌。与传统腹腔镜相比,机器人系统具有高清3D视野、多自由度的器械设计、精细操作的优势,临床实际应用优势明显。华中科技大学同济医学院附属同济医院自2015年2月开展第一例机器人肝切除以来,迄今共开展各类机器人腹腔镜肝切除300余例,手术方式涉及半肝、右后叶、尾状叶等肝脏各个领域。而且华中科技大学同济医学院附属同济医院的经验提示,机器人肝切除的学习曲线比传统腹腔镜要短,只需要30例左右即可,明显更容易上手。中国香港Eric Lai报道135例肝癌病人对比研究,其中机器人肝切除术100例,传统腹腔镜手术35例;与腹腔镜组比较,机器人组除了手术时间更长外,其他术中出血量及并发症率、R0切除率、无瘤生存率和5年生存率差异均无统计学意义。但这两组样本量差异较大,而且两组肿瘤体积、位置及肝切除范围方面可比性较差,结论还需要进一步研究。我们同时进行一项比较机器人与传统腹腔镜肝切除治疗肝癌的前瞻性队列研究,目前还在持续随访过程中,初步结果提示,两组近远期疗效相当。当然,现阶段达芬奇机器人系统也存在诸如整体系统较为昂贵、器械费用较高、机器臂系统过于庞大等弊端,这些问题亦造成其短期内还是无法广泛推广使用。
三、肝切除理念标准化
近十年,关于肝切除治疗肝癌的理念取得一些进展。
(一)解剖性切除还是非解剖性切除的理念之争
Moris等总结12429例肝癌肝切除病例,其中解剖性肝切除6839例,非解剖性切除5590例。结果表明,解剖性肝切除组术后1、3、5年无瘤生存有明显获益,但是两组总体生存率并无明显差别。而日本Eguchi报道在单发肿瘤直径分别<2cm、2~5cm、>5cm三组中,只有2~5cm组接受解剖性肝切除的病人无瘤生存瘤获得明显提高。事实上,2015年关于腹腔镜肝切除的盛冈共识明确指出对于肝癌应该行解剖性肝切除。但是2018年欧洲肝脏研究学会(EASL)肝癌指南推荐,目前证据还是认为解剖性和非解剖性肝切除方式都是可选的。而且对于直径<2cm的单发肝癌,切除和消融治疗都可以作为一线选择,这在某种程度上亦是认可了非解剖性肝切除的地位。
因此,《肝细胞癌外科治疗方法的选择专家共识》和《原发性肝癌诊疗规范(2019年版)》都明确肝癌肝切除的基本原则是:①彻底性:完整切除肿瘤,切缘阴性;②安全性:保留有足够功能肝组织,降低手术死亡率及手术并发症。
判断肝癌根治性切除标准包括术中和术后两部分:
(1)术中判断标准:
①脉管未见肉眼癌栓;②无邻近脏器侵犯,无肝门淋巴结或远处转移;③切缘超过1cm或尽管切缘小于1cm但组织学检查证实切缘阴性。
(2)术后判断标准:
①术后2个月影像学未见肿瘤病灶;②如术前甲胎蛋白(AFP)阳性,术后2个月AFP水平恢复到正常范围。
只要符合上述标准,均是治疗肝癌的合适手段。而解剖性切除或非解剖性切除均是治疗肝癌的常用手术技术,并没有作倾向性推荐。事实上,中国肝癌病人中超过80%有乙型病毒性肝炎背景,这其中半数以上的病人有肝硬化背景,有时候是否行解剖性切除,并不是由医生的个人意愿决定的,具体肝切除范围还要考虑到病人肝功能情况、肝硬化程度以及肿瘤相关因素等。目前华中科技大学同济医学院附属同济医院的做法是两种肝切除策略并存,推荐行解剖性肝切除,但要把病人安全性保证放在首要位置,尤其是对于那些直径在2~5cm范围内的单发肝癌病人。以机器人肝切除肝癌病人为例,前期121例肝癌病人,有84例接受解剖性肝切除,其余37例行非解剖性肝切除。
(二)肝切除时是否需要血流阻断
近年来,国内有一部分学者认为,肝切除时无需阻断血流,这样可以减少肝组织的缺血再灌注损伤。事实上,有太多临床证据表明,肝切除过程中采用入肝血流阻断(即Pringle法,图3),只要遵循一定的原则(15分钟阻断—5分钟再灌注,对于肝硬化可变更为10分钟—5分钟再灌注),即使多次阻断,对于术后的肝功能恢复并无明显影响。为此,中华医学会外科学分会肝脏外科学组亦专门对目前临床常用的一些血流阻断方法及选择原则进行了共识性描述。我们认为,合理的血流阻断技术及术中控制性低中心静脉压的应用可以使手术视野清晰、病人安全性得到很好的保障。对于低中心静脉压技术,有两种方法可供选择:一种是传统意义上麻醉师掌握的控制性低中心静脉压技术,需要应用硝酸甘油、呋塞米等药物;另一种是我们中心提出的入肝血流阻断联合肝下下腔静脉阻断技术,通过阻断肝下下腔静脉(图3)减少60%~70%的回心血流,使中心静脉压迅速下降。当然,并不是所有病人均需要使用这些技术,正如中华医学会外科学分会肝脏外科学组关于术中控制出血方法和选择原则中所指出,肝切除术中控制出血方法的选择与病人的年龄、全身情况、肝硬化程度、肝脏储备功能以及肿瘤大小、部位、肝切除范围、手术方法有关,需要结合术者经验及手术室设备条件等多方面因素灵活运用,一切的原则和前提就是要把病人的安全放在第一位。

图3 机器人肝切除术中应用Pringle法联合肝下下腔静脉阻断技术
A.Pringle法;B.肝下下腔静脉;C.肝下下腔静脉绕置阻断带;D.阻断肝下下腔静脉。
(三)导航技术(超声、ICG、混合现实技术)在肝切除中的应用
可视化技术使肝切除更加安全。关于超声导航,早在20世纪80年代,日本Makuuchi教授首先在肝切除过程中运用超声技术。目前术中超声在肿瘤定位、肝切除规划、管道注射穿刺和消融引导等方面均有独特的优势。近年来,随着临床上腹腔镜肝切除术的广泛开展,腹腔镜超声的使用亦越来越普及,其图像分辨率高,可以发现很多微小的卫星灶和转移灶、标记重要管道结构、切缘的确认、引导穿刺等,作为肝胆外科医生的“第三只眼睛”,弥补了腹腔镜肝脏手术因丧失触觉而造成一些探查和辨别障碍,有效提高了腹腔镜肝切除术的安全性和有效性。
目前,随着机器人腹腔镜肝切除术的不断开展,华中科技大学同济医学院附属同济医院结合术中超声使用经验,首次提出了机器人肝切除四步法超声使用步骤:探查、辨别、导航及确认。在前期110例机器人肝切除病人中,有10%发现了意外小病灶,其中6例为肝癌病人,除1例意外小病灶位于拟切除肝脏范围外,其余5例均需调整手术方案。这些数据表明术中超声在肝切除过程中的重要性,尤其是针对包括机器人在内的腹腔镜肝切除而言,由于缺乏直接触觉反馈,术中超声即显得尤为重要。
ICG荧光显像技术目前在传统腹腔镜肝切除中应用较为广泛,是热点之一。这一技术在肿瘤标记、肝叶或肝段的染色方面作用突出,但也存在一些明显缺点,比如荧光穿透性差、假阳性率高、受肝硬化等因素影响难以把控ICG注射时间和浓度等。随着技术设备不断升级,上述一些实时显像技术在肝切除方面的应用前景将会越来越广泛。
(四)联合肝脏分隔和门静脉结扎的二步肝切除术(ALPPS)在肝癌中的应用
这一技术是近些年发展出来的技术,适用于预期残存肝脏体积占标准肝体积不足30%~40%的病人。经过一期手术门静脉结扎同时联合肝实质离断方法,健侧剩余肝脏一般可以在1~2周后增生30%~70%,达到占标准肝脏体积至少30%的要求,从而可接受安全的二期手术切除。对于这类手术病人的选择,需要考虑到肝硬化程度、病人年龄、短期承受两次手术的能力和肿瘤在等待期内快速进展风险等。当然,在临床实际应用时,目前亦出现了一些消融、捆绑替代肝实质离断技术、腹腔镜手术降低手术创伤等改进。《原发性肝癌诊疗规范(2019年版)》列出了此类手术的一些禁忌情况,可供临床参考:①存在不可切除的肝外转移病灶;②伴随有严重的门静脉高压症的病人;③全身情况差不能耐受大手术和其他麻醉高风险病人;④一期手术中发现保留侧肝脏有肉眼可见肝癌结节病人。多数作者认为ALPPS并发症率和高死亡率均较高,因而不适合有明显肝硬化的大肝癌病例。
四、肝移植适应证扩大化
肝移植亦是治疗肝癌的外科治疗手段。目前,肝癌肝移植受体选择标准应用最广泛的仍是米兰标准,即单发肿瘤直径≤5cm或多发肿瘤≤3个,且每个直径≤3cm,同时不能有大血管侵犯和肝外转移。符合这一标准的肝癌病人肝移植术后4年总体生存率和无复发生存率分别为85%和92%。但是由于其条件过于严苛,造成大量超过米兰标准的病人无法从肝移植中获益。因此,国外学者提出了Pittsburgh标准、UCSF标准和Up-to-7标准,这些标准(表2)都在一定程度上扩大了肝移植受体选择的适应证,取得了不错的效果。
表2 肝癌肝移植受体选择标准

国内肝移植学者亦为此作出了不断努力和探索。樊嘉等提出了肝癌肝移植选择的上海复旦标准,其适应证扩大为:①单发肿瘤直径≤9cm;②多发肿瘤≤3个,且直径≤5cm;③全部肿瘤直径总和≤9cm。随访结果显示符合复旦标准的病人生存率与米兰标准相当,术后5年生存率达78.1%。郑树森等提出了杭州标准:①无大血管侵犯或肝外转移;②癌灶累计直径≤8cm或癌灶累计直径>8cm、术前AFP≤400ng/ml且组织学分级为高、中分化。这一标准创新性地引入了AFP和组织学分级等生物学指标作为标准之一,验证结果显示较米兰标准将获益人群扩大了51.5%,同时获得了相似的长期生存。国内其他类似的还有华西标准和三亚共识,最新版的规范推荐的是美国UCSF标准。在供体依然紧缺的今天,我们认为肝癌肝移植受体选择标准仍然宜紧不宜松,尤其对活体肝移植,受体选择更应慎重。
(朱鹏 陈孝平)
副教授、主任医师。擅长普通外科常见疾病的诊治,肝胆胰疑难外科疾病诊治,尤其是原发性肝癌,结直肠癌及神经内分泌肿瘤肝转移,肝血管瘤,局灶性结节性增生,肝腺瘤,胆道肿瘤,胰腺肿瘤,胆管结石和门静脉高压症的治疗,对于肝切除、肝移植,尤其擅长腹腔镜和机器人等微创手术。
教授 主任医师,中国科学院院士。华中科技大学同济医学院同济医院外科学系主任、肝脏外科中心主任、肝胆胰外科研究所所长。对普通外科疾病的诊断及治疗积累了丰富经验。在肝胆胰外科领域取得了巨大的成就,施行过各类手术一万多例。其成果得到国内外同行认同,先后获国家科学与技术进步奖二等奖、教育部提名国家科技进步奖一等奖、中华医学科技奖一等奖和湖北省科技进步奖一等奖各1项;2007年获何梁何利科学与技术进步奖;2008年获中国肝胆胰外科领域杰出成就金质奖章;2010年获教育部科学技术进步二等奖;2012年获中国抗癌协会科技奖一等奖;2013年获湖北省科技推广奖一等奖。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]夏穗生.肝部分切除手术[J].武汉医学院学报,1958,1:9.
[2]ZHANG B,ZHANG B,ZHANG Z,et al.42,573 cases of hepatectomy in China:a multicenter retrospective investigation[J].Sci China Life Sci,2018,61(6):660-670.
[3]董家鸿,郑树森,陈孝平,等.肝切除术前肝脏储备功能评估的专家共识(2011版)[J].中华消化外科杂志,2011,10(1):20-25.
[4]中华医学会外科学分会肝脏外科学组.肝细胞癌外科治疗方法的选择专家共识(2016年第3次修订)[J].中华消化外科杂志,2017,16(2):113-115.
[5]陈孝平,毛一雷,仇毓东,等.肝切除术围手术期管理专家共识[J].中国实用外科杂志,2017,37(5):525-530.
[6]中华人民共和国卫生和计划生育委员会医政医管局.原发性肝癌诊疗规范(2019年版)[J].中华消化外科杂志,2020,19(1):1-20.
[7]中国研究型医院学会肝胆胰外科专业委员会.精准肝切除术专家共识[J].中华消化外科杂志,2017,16(9):883-893.
[8]WAKABAYASHI G,CHERQUI D,GELLER D A,et al.Recommendations for laparoscopic liver resection:a report from the second international consensus conference held in Morioka[J].Ann Surg,2015,261(4):619-629.
[9]CHEUNG T T,HAN H S,SHE W H,et al.The Asia Pacific Consensus Statement on laparoscopic liver resection for hepatocellular carcinoma:a report from the 7th asia-pacific primary liver cancer expert meeting held in hong kong[J].Liver Cancer,2018,7(1):28-39.
[10]European Association for the Study of the Liver.EASL Clinical Practice Guidelines:Management of hepatocellular carcinoma[J].J Hepatol,2018,69(1):182-236.
[11]中华医学会外科学分会肝脏外科学组.肝脏解剖和肝切除手术命名及肝切除术中控制出血方法和选择原则(2017年第1次修订,第2版)[J].腹部外科,2017,30(2):75-78.
来源:人卫知识数字服务体系






 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.