垂体泌乳素细胞腺瘤(简称泌乳素瘤)是最常见的功能性垂体腺瘤,起源于腺垂体分泌泌乳素的腺细胞,能够过度分泌泌乳素(prolatcin,PRL),导致高泌乳素血症。高泌乳素血症可直接抑制垂体性腺轴功能使女性患者出现月经紊乱、闭经和不育,男性患者性功能低减。垂体泌乳素瘤对多巴胺受体激动剂治疗反应显著,药物治疗成为泌乳素瘤的主要治疗方法。多巴胺受体激动剂抵抗患者、妊娠期泌乳素瘤、男性泌乳素瘤等患者的处理仍然是临床诊疗过程中的难点。
一、流行病学
垂体泌乳素瘤的中国人群发病率等流行病学资料不详。荟萃研究发现影像学诊断的垂体腺瘤在人群中患病率为22.5%,而尸检发现率为14.4%(总计患病率16.7%)。人群中的垂体腺瘤患病率较高,但需要临床干预的比例较低。2006—2016年间,7项相关的流行病学研究发现人群中需要医疗干预的垂体腺瘤患病率为1/865~1/1471,其中泌乳素瘤占40%~66.2%。因此,泌乳素瘤是临床医生需要关注的垂体腺瘤类型。育龄期女性是泌乳素瘤的好发人群,18~50岁患者的男女性别比例为1∶10,50岁后男女患者性别比例1∶1。男性患者的发病高峰年龄显著高于女性10~15岁,女性发病高峰年龄为25~34岁。
二、病理生理
泌乳素由泌乳素分泌细胞合成和分泌,为199个氨基酸的多肽类激素,分子量约23Kd。泌乳素在循环中除了23Kd的单体外,还存在“大泌乳素”和“大大泌乳素”的形式,前者是泌乳素分子的二聚体形式,后者为泌乳素及其IgG或IgA抗体复合物以及泌乳素分子的多聚体,这两种形式的泌乳素分子具有较低的生物学活性。PRL的分泌受下丘脑泌乳素分泌释放因子(PRF)和PRL分泌抑制因子(PIF)的调节。通常情况下多巴胺、GABA等发挥 PIF的抑制作用,而TRH、VIP、5-HT、OXT等发挥刺激泌乳素分泌的PRF作用。正常生理情况下PIF的抑制作用占优势。当下丘脑病变、垂体柄破坏时,PIF的分泌或运输障碍常导致血泌乳素水平升高。雌激素是PRL分泌的重要刺激因子,既可直接作用泌乳素细胞的多巴胺受体刺激PRL的合成和分泌,也可同时抑制下丘脑多巴胺的释放,从而降低下丘脑对PRL分泌的抑制作用,最终导致泌乳素水平升高。体内泌乳素呈脉冲分泌,24小时中有4~14个分泌高峰,每个分泌高峰持续67~76分钟。泌乳素分泌峰值在入睡后,但上午10~12点为分泌谷值。PRL是应激激素,在精神紧张、运动等应激状态下分泌增多。妊娠期腺垂体泌乳素细胞的增殖和高泌乳素分泌状态与高雌激素的刺激直接相关。循环泌乳素水平在妊娠期显著升高。哺乳刺激乳头等行为亦会导致泌乳素水平的升高。
泌乳素瘤的发生机制目前并未完全揭示,研究发现多巴胺和雌激素与泌乳素瘤的发生关系密切,分别通过多巴胺D2型受体和雌激素Erα受体介导。D2受体抵抗和雌激素可以促进泌乳素细胞的增殖,而FGF-4,TGF-α等生长因子的参与促进了泌乳素瘤的发生。
单基因胚系突变是少数泌乳素瘤的发病原因,其中较为多见的是MEN1基因突变导致的多发内分泌腺瘤病1型(MEN1)。MEN1基因为抑癌基因,编码的610个氨基酸的蛋白menin主要在细胞核表达,参与转录调节、基因稳定性、细胞分裂和增殖。移码突变和无义突变等失活突使致menin功能的丧失常导致胰腺、甲状旁腺和垂体等多个内分泌腺体肿瘤发生。北京协和医院总结92例MEN1患者,发现其中70.7%的患者存在垂体瘤(其中包括影像学筛查诊断的无功能微腺瘤),其中功能性垂体瘤约占42.3%(39/92),功能性垂体瘤中最常见的类型即泌乳素瘤,约占功能垂体瘤的48.7%(19/39)。文献报道MEN1患者合并垂体瘤的比例大约30%~40%,其中泌乳素瘤约占功能性垂体瘤的半数。
少数家族性孤立性垂体腺瘤(FIPA)或者散发的泌乳素瘤患者可检测到转录因子芳香烃受体相互作用蛋白基因(AIP)的突变。一项国际多中心的61例30岁前诊断的散发侵袭性泌乳素大腺瘤患者(平均肿瘤直径29.2mm)中,7例患者发现存在AIP基因突变。泌乳素瘤也可以出现在琥珀酸脱氢酶X基因(SDHX基因)突变的患者中,这些患者可以合并嗜铬细胞瘤/副神经节瘤。
泌乳素与细胞膜上的泌乳素受体结合发挥生理作用。泌乳素受体属于Ⅰ型细胞因子受体超家族。泌乳素受体根据不同的剪切和转录起始位点具有多种异构体,不同的异构体胞外结构一致,但细胞质部分的大小和序列不同(分为短型、中等和长型),人类泌乳素受体以长型为主。泌乳素和受体结合通过细胞质激酶JAK2磷酸化活化下游信号传导通路。泌乳素受体在多种器官组织细胞上广泛表达,通过内分泌、自分泌和旁分泌发挥调节生殖、内分泌代谢、水平衡和免疫调节等重要的生理作用。泌乳素特别是对性腺轴的正常功能和女性产后泌乳发挥着重要的生理作用。而高泌乳素血症通过抑制促性腺激素释放激素的脉冲分泌抑制性腺轴的功能,同时也可以直接抑制性激素的合成。近期的啮齿类动物研究发现泌乳素能够直接作用于下丘脑神经元抑制Kisspeptin的表达,这可能是抑制促性腺激素释放激素的机制。因此高泌乳素血症的患者常常首先表现出性腺功能低减。
三、临床表现
泌乳素瘤患者临床表现通常以性腺功能低减首发,但青春发育前的儿童青少年、绝经后女性和男性患者因缺乏月经等相关的临床线索提示,直到肿瘤体积增大压迫视交叉出现视功能障碍时得以诊断。同时大腺瘤患者可以出现对周围正常垂体组织的压迫继而出现腺垂体功能低减、视力下降的临床表现。
1.高泌乳素血症相关临床表现
(1)促性腺激素型性腺功能低减
过度分泌的泌乳素可以直接抑制垂体LH的分泌频率和幅度,导致垂体性腺轴功能减低。临床女性可出现月经稀发、继发闭经和不育。青春期女性患者可因高泌乳素水平直接导致原发性闭经。男性患者性腺功能低减表现为性欲和性功能减退、不育。
(2)泌乳
由于高水平的泌乳素对乳腺的直接刺激作用,超过半数的女性和35%左右的男性患者出现泌乳的症状,可出现自发或触发泌乳。
(3)体重增加
高泌乳素血症患者常出现体重增加,研究发现65%~80%的泌乳素瘤患者超重或肥胖,显著高于其他类型的垂体瘤。体重增加的同时血脂紊乱和血糖升高的风险增加,而治疗后泌乳素水平下降的患者体重及相关的代谢紊乱可有不同程度的改善。
(4)骨密度受损
泌乳素瘤患者因性腺轴功能低减可显著影响骨骼健康,表现为骨密度的降低,甚至骨质疏松和相关骨折风险的显著升高。研究发现约80%的男性泌乳素瘤患者存在腰椎骨质疏松,32%的绝经前女性垂体泌乳素瘤患者BMD的Z值低于−2SD,其中腰椎骨量的丢失较髋部更严重。儿童青少年泌乳素瘤患者的骨密度也显著低于同年龄性别的正常人群。
(5)PRL混合瘤相关临床表现
部分泌乳素/生长激素混合瘤患者可同时合并高泌乳素血症以及肢端肥大症/巨人症的相关临床表现,例如:XLAG患者自幼的身材高大,合并高泌乳素血症是重要临床表现之一。其他少见的混合型垂体腺瘤还包括促甲状腺激素腺瘤,患者同时出现怕热、多汗等高代谢症状,实验室检查发现TSH依赖性的甲状腺激素水平升高是重要的诊断线索。
2.正常腺垂体受压导致功能低减
常常见于垂体泌乳素大腺瘤,特别是侵袭性生长的大腺瘤或巨腺瘤。儿童青少年患者常出现性发育障碍的同时出现生长停滞,提示垂体生长激素分泌障碍。部分患者可出现继发甲状腺功能低减和肾上腺皮质功能低减的临床表现,如:食欲缺乏、体重下降、怕冷等。
3.视功能障碍等局部受压症状
虽然少数垂体微腺瘤患者可因肿瘤对视交叉血供的“窃血”导致视力下降和颞侧视野偏盲,但大多数出现视功能障碍的垂体瘤患者仍是垂体大腺瘤对视交叉的直接压迫作用。垂体瘤增大压迫和上抬鞍隔使部分患者出现头痛等症状。肿瘤向单侧或两侧海绵窦侵袭性生长时,可累及第Ⅲ、Ⅳ和Ⅵ对脑神经出现眼睑下垂、复视、瞳孔对光反射消失和眼球活动障碍等临床表现。
4.垂体瘤卒中
生长较快的垂体泌乳素瘤可出现肿瘤的急性或亚急性的出血坏死。特别是突然出现的急性卒中,患者可出现剧烈头痛、恶心、呕吐等颅压升高的临床表现,部分患者突然出现视功能障碍甚至意识障碍,必要时需要进行急诊手术减压。
四、病理诊断
根据2017年WHO最新垂体肿瘤病理分型指南,过度分泌PRL的垂体肿瘤命名为垂体泌乳素细胞腺瘤,其来源于Pit-1腺垂体细胞系,分为稀疏颗粒型、致密颗粒型和嗜酸性干细胞腺瘤三种类型,除了常规的PRL免疫组化染色阳性外,更加强调转录因子PIT-1和ERα的免疫组化染色阳性。嗜酸性干细胞腺瘤常伴有散在或局部的细胞GH免疫组化染色阳性,以及小分子量的细胞角蛋白(LMWCK)染色阳性。其中稀疏颗粒型泌乳素瘤为常见类型,对多巴胺受体激动剂具有良好的治疗反应。2017版新的病理分型取消了非典型垂体腺瘤的分类,但依然提出男性泌乳素细胞腺瘤为“高危垂体腺瘤”类型,药物敏感性相对较差,需要在临床诊疗过程中更加关注和密切随访。
五、高泌乳素血症的鉴别诊断
泌乳素瘤患者的诊断主要依赖典型的临床表现,血清泌乳素水平的检测。但高泌乳素血症仍需要鉴别是生理性或药物导致的高泌乳素血症,临床上还需要除外其他导致泌乳素水平升高的疾病,最终才能确诊垂体泌乳素瘤。
1.血清PRL测定
虽然PRL的分泌呈现脉冲分泌的形式,晨起醒前是分泌高峰,上午10~12点是分泌谷值,基础PRL水平具有重要的诊断价值。正常人PRL通常不超过20~30ng/ml,但门诊检测常会有难以避免的应激状态如:运动、交通、空腹饥饿等可能会导致PRL轻度的升高,必要时请患者8点前进食少量碳水化合物(避免蛋白质和脂肪的摄入),休息30分钟后采血测定。泌乳素瘤患者的血清PRL水平通常和泌乳素瘤的直径正相关,大腺瘤患者的PRL水平通常大于200ng/ml,而微腺瘤患者PRL水平50~150ng/ml。采用放射免疫测定法或化学发光分析法等基于抗原抗体结合原理的PRL测定方法时要警惕“HOOK”效应。即当PRL水平非常高的时候测定结果显示PRL正常或轻度升高。需要鉴别是无功能大腺瘤还是泌乳素瘤出现“HOOK”效应导致的测定误差,简单的鉴别方法是稀释患者的血清100倍后重新测定。这在临床治疗的决策中十分重要,无功能大腺瘤通常需要接受手术治疗,而泌乳素大腺瘤通常对多巴胺受体激动剂具有良好的治疗反应。
2.其他导致PRL水平升高的状态或疾病
高泌乳素血症的患者需要认真鉴别可能的病因,泌乳素瘤并未唯一导致泌乳素水平升高的疾病。
(1)生理性的高泌乳素血症
作为应激激素的RPL在各种应激状态下都出现轻至中度的升高。妊娠和哺乳状态是育龄期女性泌乳素水平升高的最常见的生理性原因。妊娠期女性腺垂体的泌乳素分泌细胞增生致泌乳素水平逐渐升高到分娩前达到高峰200~250ng/ml,分娩后泌乳素水平迅速下降,但哺乳时乳头的刺激会引起泌乳素的分泌短期升高。因此出现闭经的女性,发现高泌乳素血症需首先测定性腺激素和β-hCG水平除外妊娠状态。
(2)药物相关的高泌乳素血症
引起泌乳素水平显著升高的药物包括:避孕药物、精神科用药和H2受体阻断剂。抗精神分裂症药物吩噻嗪、丁酰苯类药物通过阻断下丘脑和垂体泌乳素细胞上的多巴胺受体导致泌乳素水平的显著升高,有文献报道可到200~350ng/ml。显著升高的泌乳素水平可以导致女性患者出现月经稀发甚至停经,男性患者的性功能低减。氟哌啶醇和三环抗抑郁药物也可导致患者泌乳素水平的升高。约半数服用甲氧氯普胺和多潘立酮胃肠道药物的患者会出现泌乳素水平的升高和相关症状。长期服用阿片类药物会导致泌乳素轻度升高。
(3)泌乳素瘤外导致高PRL血症的疾病:
①下丘脑-垂体柄受累疾病:鞍区及鞍上的其他疾病,包括自身免疫相关炎症,良性肿瘤(颅咽管瘤、巨大垂体腺瘤压迫垂体柄等),恶性肿瘤(恶性肿瘤的鞍区转移、朗格汉斯细胞组织细胞增生症等),囊肿(Rathke囊肿、脓肿),外伤(下丘脑或垂体柄损伤)等导致下丘脑和垂体柄损伤时,多巴胺等PIF的分泌和运输受到影响,可导致泌乳素轻度至中度的升高。虽然文献报告下丘脑-垂体柄受累时PRL水平通常低于100ng/ml,但与泌乳素瘤患者仍有较大的检测重叠区间,因此不能单纯从泌乳素的水平推断高泌乳素的原因;②原发性甲状腺功能低减和多囊卵巢综合征(PCOS)等疾病:原发性甲状腺功能低减患者由于TRH代偿性增高,TRH作为重要的PRF直接导致PRL分泌的增加。特别是原发甲状腺功能低减的患者常伴有垂体代偿性增生,加之泌乳素水平的显著升高,易被误诊为泌乳素瘤,甚至接受手术治疗导致全垂体功能不可逆的损伤。基线状态下的TSH水平显著升高是原发性甲状腺功能低减的重要鉴别要点。多囊卵巢综合征是育龄期女性易患的疾病,临床上出现月经稀发、闭经、多毛和痤疮等高雄激素血症相关表现。约30%的PCOS患者合并轻中度的高泌乳素血症,推测可能的原因与下丘脑促性腺激素释放激素的分泌异常有关。但泌乳素瘤患者的促性腺激素显著降低,而PCOS患者典型的性腺轴激素是LH较FSH显著高,雌激素水平常不低,而高雄激素血症十分常见。PCOS患者较少出现泌乳的症状;③神经源性刺激:胸壁病灶或胸段脊髓病变可能会导致泌乳素水平的升高;④肝硬化、慢性肾衰竭等:文献报道不足10%的肝硬化患者会出现轻度高泌乳素血症。慢性肾衰竭失代偿的患者因代谢异常常合并轻中度的高泌乳素血症,透析治疗能够部分降低泌乳素水平;⑤其他罕见原因:罕见的泌乳素受体基因突变可以导致持续的高泌乳素血症。还有罕见的异位恶性肿瘤分泌导致高泌乳素血症的病例报道,如:肾细胞癌、卵巢畸胎瘤等。
(4)特发性高泌乳素血症:
未发现引起高泌乳素血症的病因的患者通常诊断特发性高泌乳素血症。推测部分患者可能的原因是微小的垂体泌乳素瘤影像学难以发现。临床随访观察,约1/3的患者泌乳素水平降至正常,10%~15%的患者泌乳素水平逐渐升高甚至可以影像发现微腺瘤,超过半数的患者维持稳定的泌乳素水平。
六、泌乳素瘤定位诊断
临床表现和生化检测确定为高泌乳素血症,需进一步完善影像学检查协助定位诊断。鞍区MRI是临床应用最广泛的影像学检查方法(图1),特别是磁共振动态增强技术能够显著提高垂体微腺瘤的检出率。同时磁共振检查能够发现下丘脑和垂体柄病变,帮助进一步对高泌乳素血症的病因进行鉴别诊断。如有磁共振检查禁忌的患者可以接受CT的检查帮助确定垂体占位的位置、大小等。
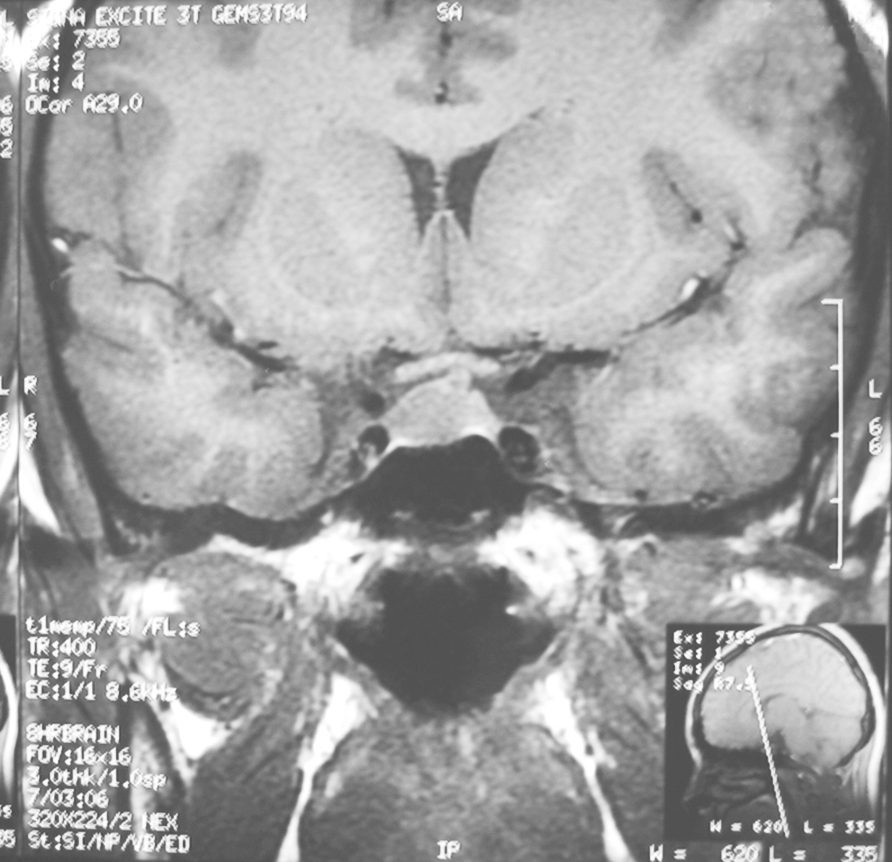
图1 垂体泌乳素瘤MRI增强扫描
鞍内可见类圆形低信号影,病灶大小约1.4cm×1.2cm×1cm;增强扫描示病灶轻度强化,强化延迟于正常腺垂体
七、泌乳素瘤的治疗
(一)治疗目标
垂体泌乳瘤的治疗目标是纠正高泌乳素血症,从而恢复正常的垂体性腺轴功能。同时尽可能的缩小肿瘤甚至使肿瘤消失,去除肿瘤对正常的腺垂体、视交叉和可能的对脑神经的压迫。预防肿瘤的复发。垂体泌乳素瘤和其他的功能性垂体腺瘤不同的是药物治疗的有效性和安全性显著高于其他垂体瘤,因此药物治疗成为大多数泌乳素瘤患者的首选和唯一治疗方法,就能够达到临床治愈的治疗目标。部分对药物不敏感或不能耐受药物治疗的患者需要考虑手术治疗、必要时选择放射治疗,以达到有效控制泌乳素水平和肿瘤的生长。
(二)治疗方法
1.药物治疗
1971年开始在临床使用的溴隐亭作为特异性的多巴胺受体激动剂,直接通过兴奋多巴胺D2受体的作用抑制PRL的合成和分泌,同时溴隐亭可以通过兴奋下丘脑的多巴胺受体增加PIF的释放间接抑制PRL分泌。口服溴隐亭半衰期约3~4小时,作用时间8~12小时。2.5~15mg/d的剂量能够显著降低血清PRL水平的同时临床上也能观察到肿瘤的缩小。大多数患者接受中等以下剂量(7.5mg)就能够有效控制PRL水平。北京协和医院临床观察约90%的女性泌乳素瘤患者接受溴隐亭治疗后能够有效控制泌乳素水平至正常范围,同时恢复正常的月经周期。文献报道78%的微腺瘤和72%的大腺瘤患者通过溴隐亭治疗可以使PRL水平正常。其中80%的育龄期女性可以恢复排卵。PRL的下降与肿瘤的缩小是显著相关的。研究报道溴隐亭治疗后24~72小时就能观察到患者视野的显著改善,通常药物治疗2周能够在MRI观察到显著的肿瘤缩小。通常治疗后的6周~6个月能够观察到显著的肿瘤缩小,但治疗6个月~1年后仍有肿瘤逐渐缩小的报道。大量的临床研究证实溴隐亭对男性泌乳素瘤患者、儿童青少年患者和妊娠期泌乳素大腺瘤患者的治疗都是安全和有效的。
溴隐亭治疗后的副作用主要与其作用于机体其他的多巴胺受体相关。大多数患者起始治疗时有恶心、便秘、头晕等胃肠道和中枢不良反应,甚至出现体位性低血压,通常建议患者从小剂量开始,如1.25mg/d,根据反应逐渐增加剂量,能够使更多的患者耐受药物治疗。仍有5%~10%的泌乳素瘤患者因不能耐受溴隐亭的副作用而无法选择药物治疗(目前国内无卡麦角林)。另外需要注意的是对溴隐亭十分敏感的大腺瘤患者治疗后需警惕肿瘤的迅速缩小甚至出现脑脊液鼻漏的临床表现。而也有神经外科手术医师报告长期溴隐亭治疗后接受手术治疗的患者肿瘤的纤维化严重,可能增加手术的难度。要关注长期接受大剂量溴隐亭治疗患者的心脏瓣膜情况,心脏瓣膜上的多巴胺D1受体是导致溴隐亭相关副作用原因,但目前多巴胺受体激动剂直接导致的心脏瓣膜病变的报道罕见。
卡麦角林是新型的麦角衍生物,是更高多巴胺D2受体选择性的药物。由于卡麦角林的半衰期长达62~115小时,因此更小剂量和服药频率使卡麦角林成为临床上广泛应用的治疗泌乳素瘤药物。通常每周0.5~2.0mg的治疗剂量就能够有效控制患者的泌乳素水平。临床研究发现86%~92%的微腺瘤患者和76%~77%的大腺瘤患者接受卡麦角林治疗能够达到泌乳素水平的正常,较溴隐亭有更好的治疗反应,而且因服药剂量和频率的减少,患者的耐受性更好,约3%~4%的患者因副作用不能耐受卡麦角林的治疗。
对于难治性垂体泌乳素瘤或泌乳素癌目前选择替莫唑胺联合放射治疗的方式能够控制部分患者肿瘤的生长。
2.手术治疗
虽然多巴胺受体激动剂具有良好的临床治疗疗效,但依然有部分患者对药物治疗不敏感或不耐受而选择手术治疗。不同的临床研究对多巴胺受体激动剂抵抗的诊断标准不一致导致发生率的差异。目前公认多巴胺受体激动剂最大剂量(如溴隐亭15mg/d)规范治疗3月泌乳素水平不能降至正常范围且肿瘤缩小不足50%可以考虑存在药物抵抗。肿瘤表面的D2受体表达量不足可能使药物抵抗的潜在原因。约15%~20%的患者对溴隐亭抵抗,而10%左右对卡麦角林抵抗。溴隐亭抵抗的患者中80%对卡麦角林具有良好的治疗反应。巨大侵袭性腺瘤和男性患者是发生药物抵抗的危险因素。药物抵抗的患者可以选择经鼻垂体瘤切除/部分切除,减瘤手术后部分患者对药物的治疗反应有改善。此外出现急性垂体瘤卒中或较严重脑脊液鼻漏的患者也需要接受手术的治疗。随着内镜等技术的开展,垂体泌乳素瘤手术的缓解率较前有了显著的提高,约81%的微腺瘤和41%的大腺瘤患者通过手术治愈,也提示泌乳素瘤患者术后的密切随访和评估的重要性,必要时启动药物治疗,以达到控制泌乳素水平和肿瘤增大的风险。
3.放射和放射外科治疗
由于药物治疗和手术治疗的有效性,因此泌乳素瘤患者较少选择放射治疗。药物抵抗、手术后仍有肿瘤残余或进展、难治性泌乳素瘤及泌乳素癌的患者需要联合放射治疗。无论是传统分割放疗或立体定向放射外科治疗对泌乳素瘤的生长都具有显著的抑制作用,能控制约71%~95%的患者肿瘤的生长,但泌乳素水平能够降至正常的患者有限,约20%~40%的患者经放射治疗后泌乳素水平能够降至正常。因此,临床上更多的患者需要多学科协作,必要时药物、手术和放射治疗联合使用达到最好的临床控制目标。
医学博士,主任医师,教授,博士生导师,内分泌科常务副主任。1995年毕业于华西医科大学,2008年赴日本熊本大学医学部交流。主持国家自然科学基金等项目,成果发表在JCEM,J Mol Endocrinol,Front Pharmacol。现任中国垂体瘤协作组委员兼秘书,中国医师协会内分泌代谢医师分会青委会副主任委员、中国医师协会青春期医学专业委员会副主任委员、北京医师协会内分泌代谢学专业委员会干事长。主编矮小症、肥胖症以及糖尿病相关书籍5本。2007年获得北京市科委“科技新星”称号。2015年获北京市科学技术奖三等奖(垂体腺瘤的规范化诊治),2016年获华夏医学科技奖二等奖(垂体腺瘤的规范化诊治和垂体功能重建)和北京协和医院“医疗成果奖一等奖”(矮小症的精准诊疗探索)。擅长内分泌代谢疾病的诊治。原临床医学博士后项目办主任。
助理研究员,医学博士。2012年毕业于中国医学科学院北京协和医学院神经外科,历任住院医师、总住院医师,对神经外科的基础理论、专业知识掌握全面。2013年至2014年赴美Cedars-Sinai医院访问学习,师从于著名垂体疾病诊疗专家Dr.Shlomo Melmed教授,对垂体疾病的诊治进行了系统的学习。作为课题负责人主持协和创新专项分课题一项,国家自然科学基金一项,北京协和医院青年科学基金两项。做为主要人员参于国家十三五重大专项课题、北京自然基金、首都卫生发展重点专项课题各1项。部分结果在第13,14届世界垂体大会上交流,第一作者在《Neurosurgery》《Endocrinology》《中华神经外科杂志》《中华医学杂志》等杂志发表论文10余篇。擅长:垂体腺瘤、颅咽管瘤、脑膜瘤等肿瘤的手术及个体化治疗。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系






 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.