46岁女性,无明显诱因出现颜面、双下肢水肿,伴眼干以及双手遇冷变白、变紫,在医院诊断为弥漫性结缔组织病,治疗4周后,水肿消退。患者自行停药后出现水肿加重,伴活动后胸闷、气短、腹胀、少尿、发热,遂住院进一步诊治。 如何进一步诊治?
一、病情摘要
1.基本情况
女性患者,46岁,以“反复水肿1年,发热10天”为主诉,于2016年10月入院。1年前,患者无明显诱因出现颜面、双下肢水肿,伴眼干以及双手遇冷变白、变紫,无发热、皮疹、关节痛,无胸闷、气短、少尿,于我院诊断为弥漫性结缔组织病,以泼尼松(40mg,每天1次)、来氟米特(20mg,每天1次)治疗4周后,水肿消退。10天前,患者自行停药后出现水肿加重,伴活动后胸闷、气短、腹胀、少尿、发热(体温最高达39.0℃),无畏寒、咳嗽、腹痛、尿频、尿痛、端坐呼吸,遂住院进一步诊治。
2.既往史
体质健康,个人史、家族史无特殊。
3.入院查体
体温37.8℃,脉搏130次/分,呼吸20次/分,血压108/82mmHg,SpO2 96%(FiO2 21%)。意识清楚,自动体位,皮肤、黏膜无皮疹、出血点,浅表淋巴结未触及肿大,眼睑水肿,无龋齿。双侧胸壁可见胸腔引流管(右侧可见黄色胸腔积液200ml,左侧可见黄色胸腔积液300ml)。双下肺呼吸音低,双下肺可闻及散在细湿啰音。心相对浊音界无扩大,心律齐,未闻及病理性杂音。腹稍膨隆,全腹无压痛、反跳痛,肝、脾肋下未触及,移动性浊音(+)肠鸣音4次/分。双手指端皮肤稍增厚,皮纹减少,皮温稍低,双下肢凹陷性水肿,关节无红肿、畸形,神经系统无异常。
4.入院前检查
(1)常规实验室检查
见表1。
表1 常规实验室检查情况
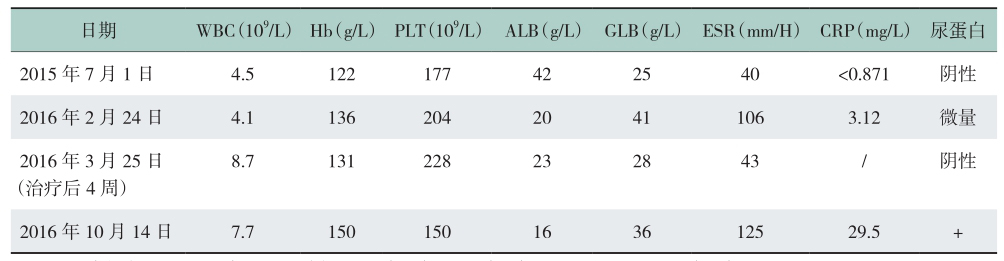
WBC:白细胞;Hb:血红蛋白;PLT:血小板;ALB:白蛋白;GLB:球蛋白;ESR:血沉;CRP:C反应蛋白
(2)免疫相关检查
补体C3(2015年7月6日) 0.36g/L,IgG 20.9g/L。自身抗体(2015年7月6日):ANA阳性(1∶1000),ds-DNA阴性,抗SSA阳性;RF阴性。
(3)X线胸片(2016年10月5日)
双肺纹理增多、增粗,双下肺夹杂斑片状、条索状密度增高影,双侧中等量胸腔积液(图1)。
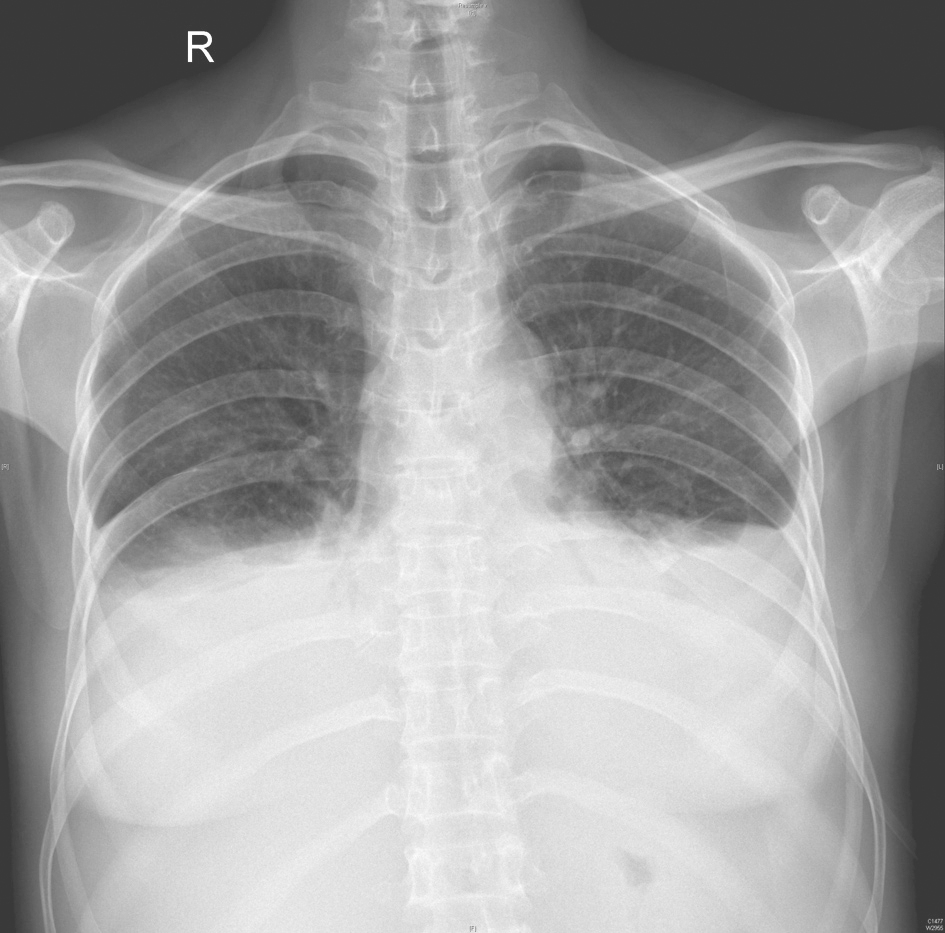
图1 X线胸片
5.初步诊断
①发热、水肿,原因待查(弥漫性结缔组织病可能);②低白蛋白血症;③双侧肺炎。
二、诊治过程
(一)病例特点
1.一般情况
患者为中年女性,慢性病程。
2.主要症状和体征
反复水肿1年,加重10天伴发热,活动后气促、腹胀、少尿,有干眼、双手雷诺现象。查体发现眼睑水肿、下肢凹陷性水肿,双手指端皮肤稍增厚、皮纹减少、皮温低;双下肺呼吸音低,可闻及散在湿啰音,移动性浊音(+)。
3.实验室检查
血白蛋白进行性下降,尿蛋白微量(+/-~+),血沉增高,补体C3下降,抗核抗体、抗SSA阳性。
4.影像学检查
X线胸片提示双侧胸腔积液、双肺斑片状及条索状密度增高影。
5.治疗反应
糖皮质激素治疗有效。
(二)鉴别诊断思路
1.本例患者发热的原因是什么?
根据病史、体征、辅助检查结果及前期治疗反应,本病例弥漫性结缔组织病诊断明确。患者1年前诊断为弥漫性结缔组织病,短期用激素病情改善后自行停药,现症状加重,故发热原因首先考虑结缔组织病所致。其次,患者入院前胸部X线检查提示双肺斑片状、条索状密度增高影,肺部听诊闻及散在湿啰音,要考虑肺部感染引起发热可能,可进一步行胸部CT、血培养及痰病原学检查明确。
2.患者发生水肿与低蛋白血症相关,那么其低蛋白血症的原因是什么?
①各种原因导致肝损害使蛋白合成障碍;②蛋白质摄入不足;③肿瘤、结核等慢性病消耗过多;④各种途径导致蛋白丢失过多。本例患者不存在前三种情况,故低蛋白血症可能与蛋白丢失过多相关。患者病程1年,属慢性蛋白丢失,其丢失部位可能位于肾或胃肠道。肾脏病变是最常见的蛋白丢失原因,且有尿蛋白,无胃肠症状,故应先检查肾脏的情况,如24小时尿蛋白定量,必要时可行肾活检。
(三)诊治措施
1.入院后相关检查
(1)一般检查
血常规:WBC 5.8×109/L,N% 66.1%,RBC 3.78×1012/L,Hb 112g/L,PLT 150×109/L。ESR 125mm/h,CRP 29.50mg/L。血生化:白蛋白12g/L,球蛋白36g/L,甘油三酯2.98mmol/L,总胆固醇6.92mmol/L,ALT、AST、BUN、Cr正常。尿蛋白(+),24小时蛋白尿0.312g/24h(尿量1500ml)。肌钙蛋白I、NT-proBNP正常。甲状腺功能:T3 1.92nmol/L,T4 48.03n mol/L,TSH 1.81mIU/L。
(2)免疫相关检查
自身抗体:ANA(1∶3200)阳性,抗ds-DNA阴性,抗Sm阴性,抗SS-A阳性,抗SS-B阴性。RF、CCP、抗心磷脂抗体、ANCA均阴性。
体液免疫:IgG 15.8g/L,IgA 1.67g/L,IgM 3.220g/L,补体C3 0.65g/L,补体C4 0.18g/L。
(3)肿瘤标志物
CA125 961.50U/ml,AFP、CEA、CA199正常。
(4)感染相关检查
降钙素原0.1ng/ml。TB-SPOT、HBsAg、HIV、RPR、病毒检查全套指标(TORCH)均阴性。血曲霉菌抗原、真菌D-葡聚糖检测正常。血培养阴性。
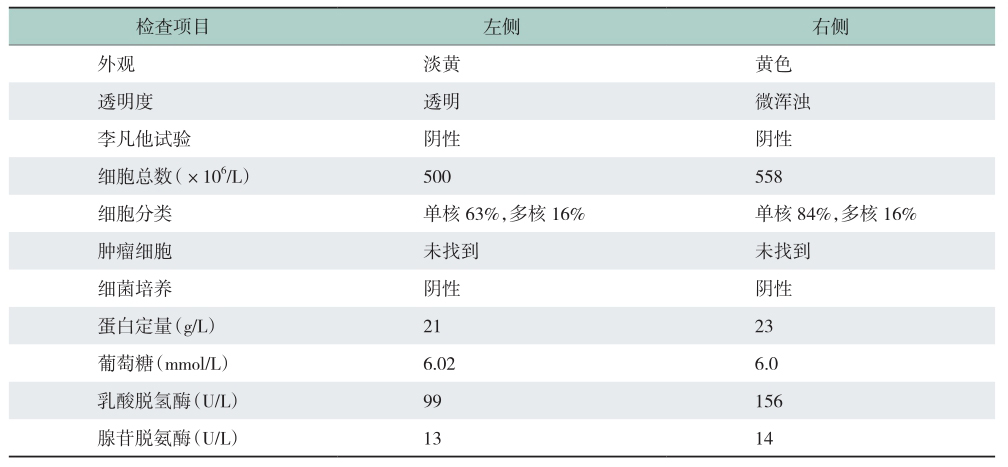
(5)胸腔积液检查
见表2。
表2 胸腔积液检查结果
(6)胸部CT(2016年10月18日)
①左肺上叶纵隔旁团片状阴影(2.9cm×2.5cm);②双肺上叶少许纤维硬结灶,双肺散在炎症;③左侧中等量胸腔积液,右侧胸腔少量积液,邻近双肺下叶组织膨胀不良(置管引流后);④纵隔内及双侧腋窝多发小淋巴结;⑤心包少量积液(图2)。
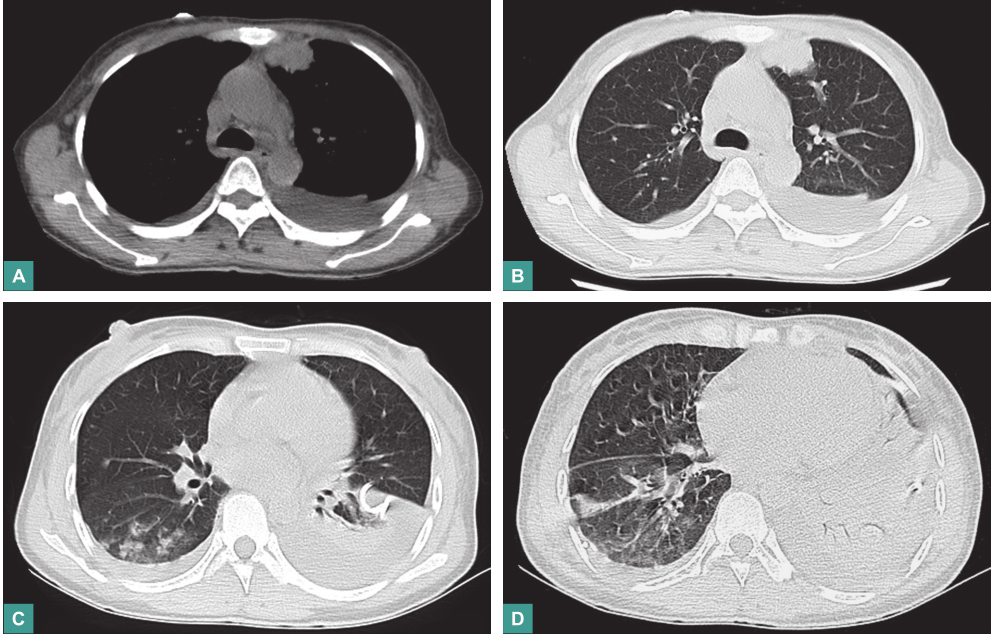
图2 胸部CT表现(2016-10-18)
(7)腹部彩超
肝内胆管结石,胆管无扩张,盆腔积液,子宫及附件未见异常。
(8)心脏彩超
主动脉瓣回声增强伴反流(+),左心室舒张功能减退。
(9)涎腺ECT
双侧涎腺摄取、分泌及排泄功能未见异常。
2.入院后相关治疗
给予美罗培南(1.0g,每8小时1次)抗感染,甲泼尼龙(80mg,每天1次)抗炎,低分子量肝素抗凝、利尿治疗,患者体温恢复正常。患者拒绝行肾穿刺及唇腺活检。13天后(2016年10月31日)复查胸部CT:左肺上叶纵隔旁团片状阴影稍缩小(2.6cm×2.0cm);左侧少量胸腔积液,右侧胸腔中等量积液,较前有所吸收(图3)。
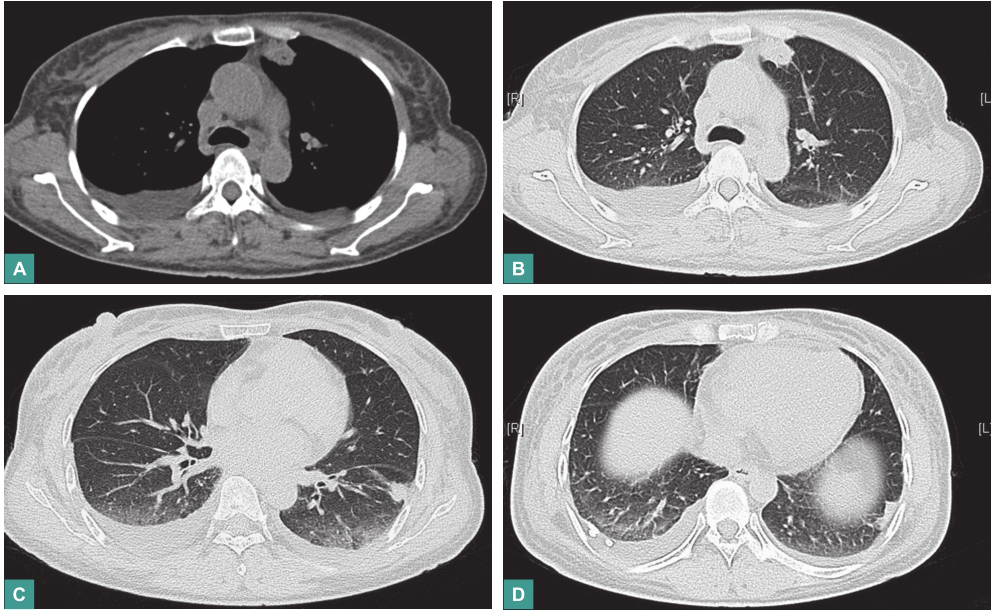
图3 复查胸部CT表现(2016-10-31)
患者体温控制,肺部病灶缩小,但下肢水肿无改善,腹胀加重,尿少(用呋塞米80mg/d利尿,尿量仅1000ml左右),两侧胸腔积液引流量300~400ml/d,食量明显减少。查体见腹膨隆,呈蛙状腹,无压痛及反跳痛,腹部移动性浊音阳性,肠鸣音3次/分。腹水常规:外观乳糜状,乳糜试验阳性,李凡他试验阳性,细胞计数225×106/L,单核细胞93%,多核细胞7%,涂片未找到肿瘤细胞,白蛋白10g/L,葡萄糖7.21mmol/L,LDH 216U/L,血清-腹水白蛋白梯度(serum-ascites albumin gradient,SAAG)<11g/L,提示非门脉高压性腹水。复查显示,尿蛋白微量,24小时尿蛋白定量0.15g,血白蛋白仅11g/L。
患者出现乳糜腹水,提示腹部淋巴系统受损,其可能原因有:①损伤性因素(如手术、创伤):本例患者无相关病史,可排除;②阻塞性因素(如丝虫病、肿瘤腔外压迫):患者胸部CT提示纵隔占位病变,性质不明,不能排除肿瘤,应多次重复腹水检查及影像学检查;③炎症因素:可能为结缔组织病引起淋巴系统病变,同时必须排除腹腔结核感染。复查全腹B超显示腹腔大量积液,未见占位病变;多次腹水未找到肿瘤细胞,涂片未找到抗酸杆菌,细菌培养阴性,腹水腺苷脱氨酶(adenosine deaminase,ADA)正常。综上分析,考虑本例患者出现乳糜腹水,为结缔组织病导致淋巴系统损害可能性大。
患者尿蛋白丢失量与低白蛋白水平不一致,不能用肾脏蛋白丢失来解释明显低蛋白血症,故考虑存在肠道蛋白丢失。2016年11月4日行放射性核素99mTc标记人白蛋白核素显像检查,注药后3小时见右下腹相当于回肠走行区、回盲部放射性异常浓聚,此后浓聚灶沿远端方向延伸(图4),符合肠道蛋白丢失影像表现。
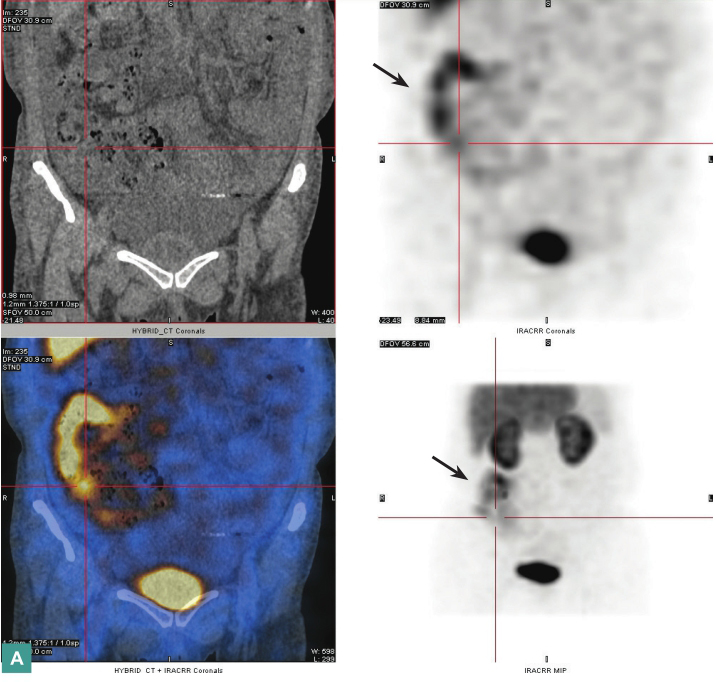
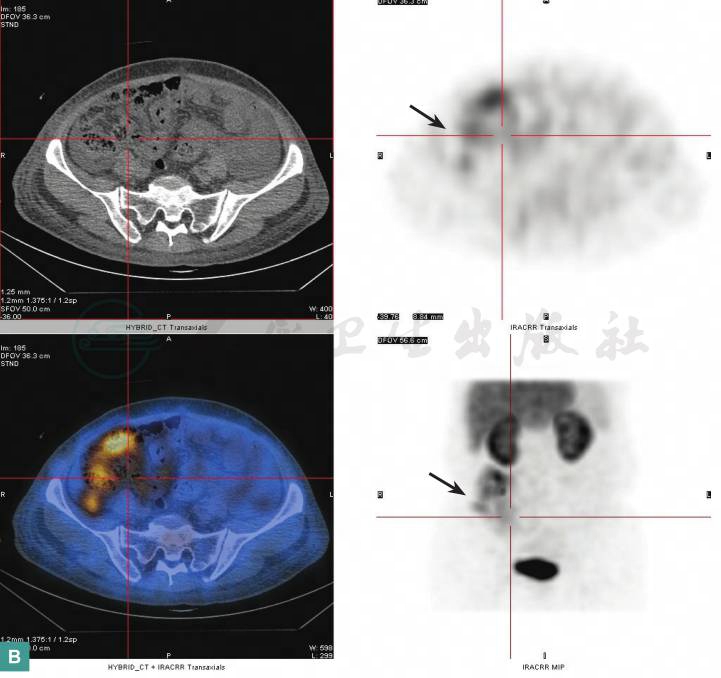
图4 99mTc标记的人ALB人体内示踪检查
3.最后诊断
①未分化结缔组织病;②蛋白丢失性肠病;③双侧肺炎;④纵隔占位病变,性质待查。
(四)临床转归
2016年11月5—11月7日,给予甲泼尼龙冲击治疗(500mg/d)随后改为甲泼尼龙48mg/d维持,并给予环磷酰胺1.0g/次冲击治疗,患者下肢水肿、腹胀消退,腹水消失,无发热、胸闷、气促,利尿剂逐渐撤退,拔除胸腔引流管,2周后复查显示血白蛋白上升至24g/L。患者病情稳定出院。
出院后,患者于门诊随诊1年,以甲泼尼龙8mg/d+环磷酰胺0.6g/d维持,一般情况好。复查显示(2017年7月23日):WBC 6.1×109/L,Hb 129g/L,PLT 217×109/L;尿蛋白阴性;肝功能:ALB 44g/L,GLB 22g/L,ALT及AST正常;ESR 17mm/h;胸部CT显示双肺内散在纤维条索灶,部分慢性炎症,原双肺多发病变较前大部分吸收,双肺胸腔积液及心包积液较前基本吸收,未见纵隔阴影(图5)。
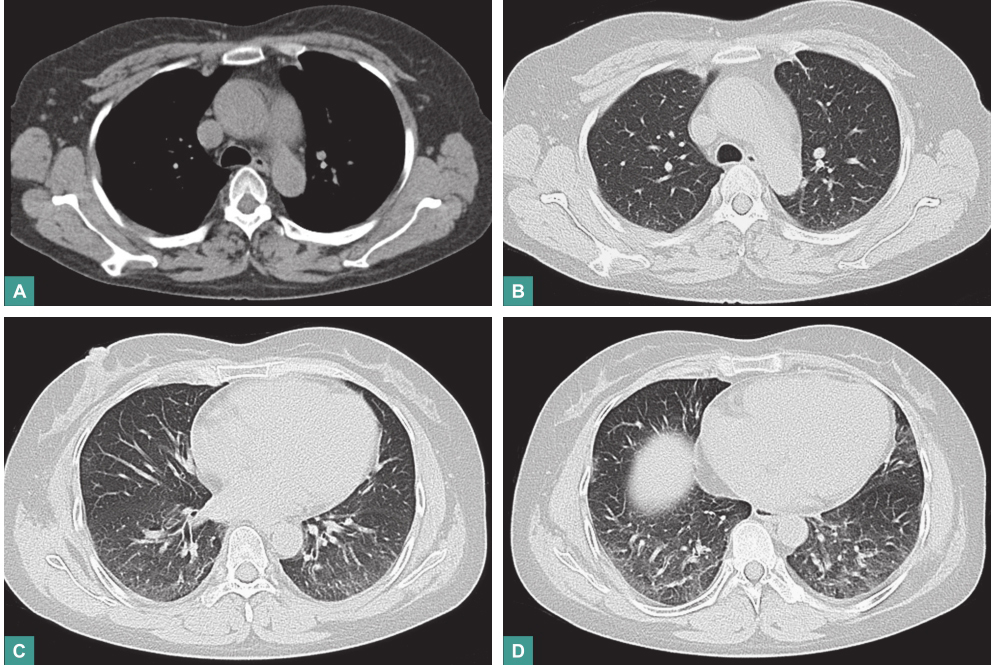
图5 胸部CT表现
(五)临床难点
1.本病例属于哪种具体的弥漫性结缔组织病?
弥漫性结缔组织病包括以下具体疾病:
(1)系统性红斑狼疮(SLE)
患者有蛋白尿、多浆膜腔积液,ANA阳性(1∶3200),补体C3下降,故为SLE可能性最大。但患者SLE特异性抗体(抗ds-DNA及抗Sm抗体)阴性、胸腔积液检查证实为低蛋白血症引起的漏出液、24小时尿蛋白定量仅0.312g,且因患者拒绝未行肾脏病理检查。因此按照2012年美国风湿病学年会(ACR)的SLE分类标准,目前本病例SLE诊断证据不充分。
(2)干燥综合征(Sjögren syndrome,SS)
本例患者有干眼症表现,抗SSA阳性,但无口干、腮腺肿大病史及体征,腮腺显像未见异常,且因患者拒绝未行唇腺活检,根据干燥综合征国际分类诊断标准,诊断依据不充足。
(3)系统性硬化症(systemic sclerosis,SSc)
患者有雷诺现象,体检发现双手指端皮肤稍增厚,要考虑SSc可能。SSc胃肠道病变主要是食管受累(75%~90%),括约肌失弛缓及蠕动下降,并有胸骨后或上腹饱胀或灼痛感,以肠道蛋白丢失症为主要表现少见,且不会出现补体C3明显下降。故本病例不能确诊SSc。
综合上述分析,目前本病例诊断未分化结缔组织病(undifferentiated connective tissue disease,UCTD),其病程转归可能分化为某一结缔组织病或持续未分化,需要长期临床随访。
2.患者胸部CT提示纵隔旁团片状阴影,原因可能是什么?
原因可能为肿瘤、结缔组织病的肺部病变以及感染。因患者拒绝,未行纵隔团块穿刺病理检查,无法明确肺部阴影性质。但从激素及免疫抑制剂治疗反应及随诊情况(复查胸部CT示纵隔团片状阴影已吸收),可排除肿瘤及感染,不排除结缔组织病肺部病变。
3.肠道蛋白丢失症如何诊断?
蛋白丢失性肠病(protein-losing enteropathy,PLE)指各种病因引起的蛋白质,特别是血浆蛋白经肠道黏膜向肠腔内异常大量排出,随粪便丢失,导致低蛋白血症的一组疾病,并非一个独立的疾病,而是一种病理生理过程。99mTc标记人血清白蛋白核素显像、粪便α1抗胰蛋白酶测定可证实蛋白从肠道丢失。
PLE非常见病且病因复杂,肠道炎症性疾病、自身免疫性疾病、淋巴管异常和感染等病因均可引起PLE,其中系统性红斑狼疮和小肠淋巴管扩张分别占45.9%和10.7%。影像学或内镜、手术及病理检查有助于明确PLE的基础病因。本病例诊断为未分化结缔组织病,通过99mTc标记人血清白蛋白核素显像证实肠道蛋白丢失,可惜未能行胃肠镜检查排除其他胃肠道病变及淋巴管扩张症。对于PLE,以治疗原发病为主,预后与是否控制原发病有关。本例患者经过大剂量激素冲击及环磷酰胺治疗后,病情控制。由此也可证明其肠道蛋白丢失原因为结缔组织病累及肠道淋巴管所致。同时,乳糜腹水的出现亦提示腹腔淋巴管损害。
三、点睛析评
风湿免疫病常累及肾脏,临床上容易将低蛋白血症原因归结为肾脏受累。风湿免疫病并发PLE并不多见,主要见于系统性红斑狼疮、未分化结缔组织病以及消化系统损害。肠道99mTc标记人血清白蛋白核素显像检查对诊断PLE较为敏感和特异,值得临床重视。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
