糖尿病(diabetes mellitus,DM)是由遗传和环境因素共同引起的一组以糖代谢紊乱为主要表现的临床综合征。胰岛素缺乏和胰岛素作用障碍单独或同时引起碳水化合物、脂肪、蛋白质、水和电解质等的代谢紊乱,临床以慢性高血糖为主要特征,其急性并发症有糖尿病酮症酸中毒、高渗性高血糖状态和乳酸性酸中毒。糖尿病可并发多种慢性并发症,导致器官功能障碍和衰竭,甚至致残或致死。全世界的糖尿病患病率迅速增加,发展中国家尤为明显,糖尿病已经成为临床上的主要内分泌代谢病。1980年,我国14省市30万全龄人群的调查结果显示,糖尿病患病率为0.67%;而2007—2008年的我国11省市4.2万人的调查发现,20岁以上人群中的糖尿病患病率已达9.7%。据报道,目前我国有糖尿病患者约9000万,城镇发病率平均约9.7%[1]。
【T1DM流行病学】
(一)T1DM发病率
T1DM的最低年发病率不足1.0/10万,最高为36.0/10万,相差30多倍。在种族发病中,白种人儿童T1DM的发病率最高,黄种人发病率最低。据1993年的统计,全世界不同地区的T1DM发病率有很大差异,北欧国家T1DM的发病率高,最高的是芬兰人,达36.0/10万人年,而东南亚地区则较低,约2.0/10万人年左右。在世界上,有些土著人聚居区如北极周缘区及某些黑非洲人群,儿童T1DM极为罕见。在地中海地区,T1DM患病率最低的是马其顿(2.45/10万人年),而最高的是萨丁尼亚(34.4/10万人年)。
我国的一项调查显示:1988—1996年期间<15岁儿童T1DM的平均确定校正发病率为0.59/10万人年,按全国人口年龄构成的标化发病率为0.57/10万人年,是世界上已报道的T1DM发病率最低的国家之一;我国儿童T1DM的发病率在逐年上升;发病率随年龄的增长而增加;女孩的T1DM确定校正发病率高于男孩(女0.66/10万人年,男0.52/10万人年);民族间发病率的差异达12倍;发病率在不同地区之间呈现明显的南低北高现象[2]。尽管我国是世界上T1DM发病率最低的国家之一,但由于人口基数大,故T1DM患者的绝对例数并不少。据估计,目前我国T1DM患者总数在200万~300万。
我国香港15岁以下人群T1DM的患病率(1984—1996)为1.4/10万人年。其中,0~4岁、5~9岁和10~14岁T1DM的患病率分别为0.9/10万人年、1.5/10万人年和1.7/10万人年。男童T1DM的发病率为1.2/10万人年,女童为1.7/10万人年。从13年的发病率分布情况看,T1DM的患病率在逐年增加,平均以0.14/10万人年的速度递增[3]。芬兰T1DM的发病率很高,并仍在逐年增加,其他欧洲国家也有类似发展趋势。据估计,整个世界经过一代人,T1DM的发病率增加1倍。一般将这种T1DM发病率上升的趋势归因于一些环境因素的改变,如用人工喂养代替母乳喂养的增多、儿童期食品中含有某些化合物(包括牛奶蛋白和硝酸盐等)、对T1DM治疗的加强使其生存时间延长及T1DM患者生殖能力的改善等,但这些尚缺乏循证医学的证据。
6个月以内婴儿很少发生T1DM,其发病从9个月开始并持续升高。资料显示12~14岁是T1DM的发病高峰,然后下降。我国20个地区的资料显示10~14岁发病达高峰[2]。应该注意,T1DM可见于任何年龄,即成年人和老年人亦可发生T1DM,只是随着年龄增长,其发病率越来越低而已。
(二)T1DM发病季节流行特点
T1DM的发病具有季节流行特点,秋冬季的发病率(10月份)最高。在北半球,秋天及冬天新诊断的T1DM病例较多,春天及夏天相对较少。中国北方地区T1DM的发病率高于南方,T1DM的发病有周期倾向,在寒冷地区和冬季T1DM的发病率增加[4]。有学者提出T1DM在北欧发病率明显增多与寒冷的气候有关,可能是寒冷气候导致某些遗传基因的突变,影响1条或多条代谢通路,使血糖和甘油等升高抵御寒冷的保护性适应(又称御寒进化适应)所致[5]。这种季节性的趋势尤其多见于青春期前后发病者,1岁以内发病者则不明显。这可能是由于胰岛β细胞的破坏在临床疾病发作前的数年已经开始,这种季节性的变化可能仅反映了对环境中糖尿病诱发因素的个体敏感性的季节性变化。此外,在冬天寒冷季节,机体对内源性胰岛素的需求量增加,从而使β细胞已被部分破坏的亚临床者发生糖尿病。T1DM春夏季节发病率低、冬秋季高,提示感染因素参与的可能性。T1DM发病率的高低与病毒感染的流行一致有关。新生儿T1DM的发病与母亲病毒感染(高峰在1月份)的关系十分密切。这提示母亲的病毒感染通过某种途径转移到胎儿体内,引起胎儿的胰岛破坏[6-8]。
由于糖尿病流行病学调查的对象、人数、民族、地区、时间、经济社会和自然环境的差异,得到的结果也不尽一致。目前的研究显示,T1DM流行病学的一般规律是:①主要见于15岁以前的儿童和未成年人;②亚洲及我国的发病率相对较低;③各国T1DM的发病均较以前有逐年增加趋势,但增加速度要比T2DM慢;④不少地区T1DM的发病率与季节有关,四季分明地区的T1DM发病的高峰多在冬秋季节,但其确切原因未明。
【T1DM病因与发病机制】
目前认为,T1DM的病因与发病机制与遗传因素、环境因素及自身免疫因素均有关。遗传在T1DM的发病中有一定作用。对T1DM同卵双胎长期追踪的结果表明,发生糖尿病的一致率可达50%;然而从父母到子女的垂直传递率却很低,如双亲中1人患T1DM,其子女患病的风险率仅2%~5%。
遗传学研究显示,T1DM是多基因和多因素共同作用的结果。现已发现,与T1DM发病相关的基因位点至少有17个,分别定位于不同的染色体。目前认为,人组织相容性抗原(HLA)基因(即T1DMl基因,定位于染色体6p21)是主效基因,其余皆为次效基因。90%~95%的 T1DM患者携带HLA-DR3、-DR4或-DR3/-DR4抗原,但 HLA-DR3和-DR4抗原携带人群只有0.5%发生T1DM,这提示HLA-DR3和-DR4是T1DM发生的遗传背景,而HLA-DQ位点则为T1DM易感的主要决定因子[9-12]。
(一)主效基因和次效基因
家系调查发现T1DM患者中的单卵双生糖尿病发生的一致率为30%~50%。同卵双生子随时间延长,其β细胞自身免疫反应的一致性约为2/3。同卵双生如果T1DM是在15岁以后发病,则与非同卵双生同胞的一致率相似,如果在10岁以前发病,则前者的一致率比后者高。一般而言,T1DM在儿童期发病时的年龄越小,则遗传因素在发病中所起的主导作用越大。
HLA易感基因在T1DM发病中的作用不足50%;家系研究也显示,单卵双生T1DM的一致率约为30%~50%,而在T2DM一致率为100%;T1DM亲属发生T1DM的机会显著高于一般人群,但垂直传递率不高,提示T1DM发病中有遗传因素的参与。T1DM的遗传为多基因性,至今已有20多个位点定位在染色体,其中研究得较为深入的易感位点主要是组织相容性复合体(MHC),在人类为白细胞抗原(HLA),位于6p,其等位基因为共显性,T1DM的遗传主要通过HLA。HLA的A、B和C抗原为Ⅰ类抗原,而HLA的D抗原为Ⅱ类抗原,HLA-TNF-α、TNF-β、补体 C2、补体 C4 及 21-羟化酶为Ⅲ类抗原。HLA三类抗原的基因都与T1DM的发病有关,其中HLA-Ⅱ类抗原基因(包括DR、DQ和 DP等位基因点)与T1DM发生的关系更为密切(表1和图1)。T1DM中40%的遗传易患性由HLA部位的主要基因决定。在全基因组关联研究(GWAS)前的几十年中鉴定了基因组的6个T1DM易感位点,应用高通量单核苷酸多态性筛选发现了近60个新的相关位点。
表1 T1DM的遗传易感位点
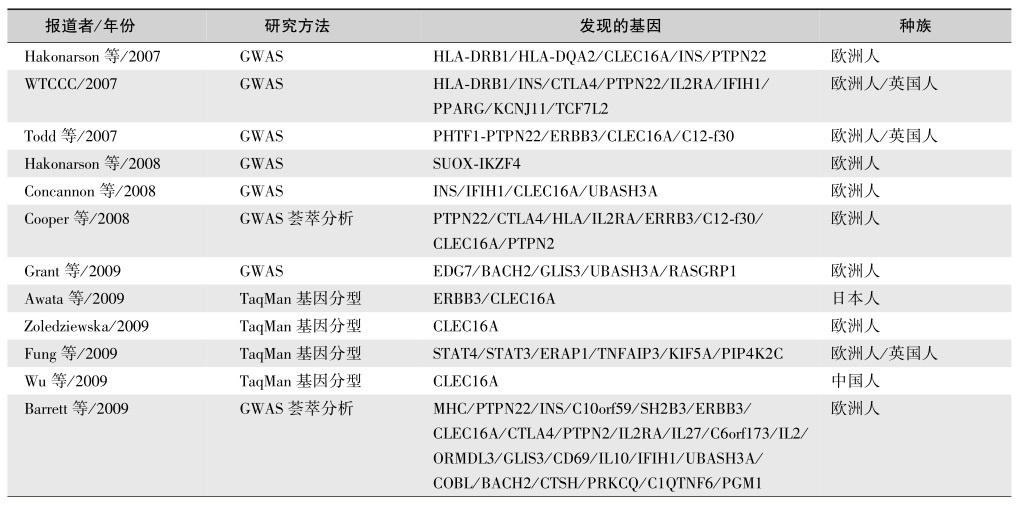
续表
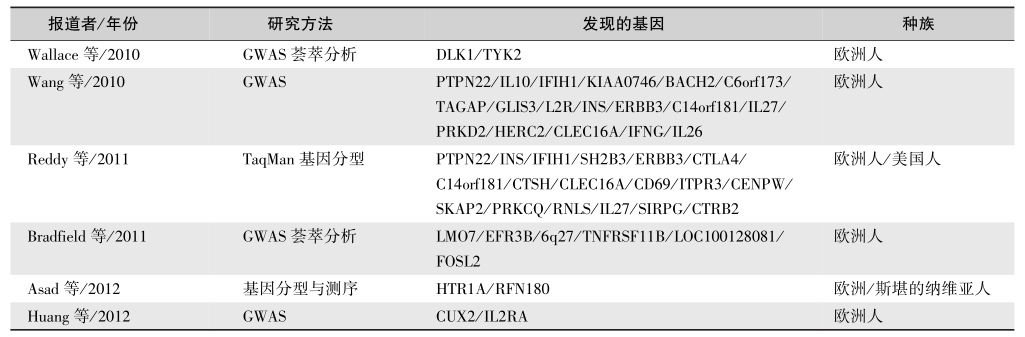

图1 T1DM易感位点
(二)遗传易患性
孪生儿研究显示同卵双胎发病的一致率约为50%。家族研究发现T1DM兄妹累积发病率20倍于无家族史人群。一般认为T1DM的遗传易患性系第6对染色体上的HLA基因所控制,T1DM单体型已确定的共有39种,与这些单体型相关的绝对危险性是25~210,其中单体型A1、C1、B56、DR4和DQ8具有非常高的绝对危险性。在芬兰,DR4和DQ8的基因频率高于世界其他人群,这可能是芬兰糖尿病发病率高的原因之一。据估算,遗传因素可解释芬兰T1DM 75%的危险性。其他可能的环境因素为:母乳喂养时间短、早期加用牛奶、亚硝酸盐和咖啡的大量摄入等,也可能是遗传易感个体T1DM的触发因素。引起T1DM发病的个体变异因素还有应激(包括精神应激和社会应激)事件,可能通过升高相关激素的水平,导致对内源性胰岛素需求量的增加,在β细胞已经部分破坏的个体中加速其糖尿病的发生。
通过基因组筛选,已发现数个T1DM的易感基因。根据易感基因的强弱和效应主次,将T1DM1基因(或称IDDM1,即HLA基因,定位于6p21)定为T1DM的主效基因。T1DM1基因主要为HLA-ⅡDQ和DR的编码基因,其中DQA1∗0301-B1∗0302(DQ8)和 DQA1∗0501-B1∗0201(DQ2)与T1DM 的易患性相关,DQA2∗0102-B1∗0602(DQ6)与 T1DM的保护性相关。同样,DR3和DR4也与易患性相关,DR2与保护性相关。近年来,我国不同地区对HLA-DQ基因型与T1DM的关系进行了研究,桑艳梅等报道 DQA2∗0501、DQA1∗301、DQB2∗201和 DRB1∗0301为中国北方人T1DM的易患性基因[13],DQA1∗0103和 DQB1∗0601为T1DM保护性基因;湖南地区汉族T1DM的易患性与DQB1∗0201和0303基因频率增加有关,保护性与DQB1∗0301减少有关。国际人类基因组研究的开展为多基因常见病全基因组连锁作图创造了条件,T1DM的多基因遗传系统已初步揭示,至少包括 IDDM1/HLA、IDDM2/胰岛素 5'-VNTR 以及新基因IDDM3~IDDM13和IDDM15,见表2。此外,有可能连锁但尚未给予正式命名的标志位点有GCK3、DIS1644-AGT和DXS1068等。
表2 T1DM的连锁基因及其定位

注:IDDM,胰岛素依赖型糖尿病;CTLA4,细胞毒性T淋巴细胞相关抗原4
T1DM易感基因非HLA定位研究虽无一致性结论,但进展很快。与T1DM相关的基因位点除在HLA上外,还与胰岛素、CTLA4(Thr17Ala)、细胞黏附分子 1(ICAM1,Lys469Glu)、γ-干扰素(IFNG、CA repeat和intron 1)、免疫球蛋白重链可变区2-5B(IGHV25和Allele3.4)、白细胞介素受体1型(IL1R1和 PstLRLFP)、白细胞介素 12B(3 'UTR allele 1)、白细胞介素-6(IL-6和-174C/G)、NEUROD1(neurogenic differentiation 1和 Ala45Thr)、L-选择素(SELL 和 T688C)、维生素 D 受体(VDR、Bsml和 Apal RELP)和 WFS1(wolframin,Arg456His)等基因位点有关。通过对HLA和非HLA易感基因的筛选有望更早地确定T1DM的高危对象。
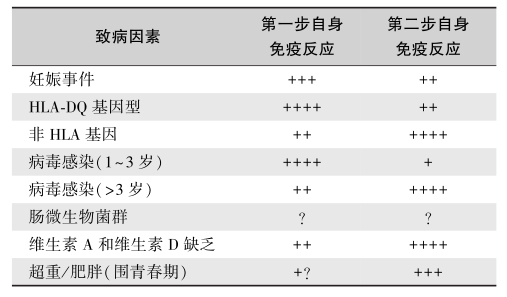
糖代谢相关的调节因子单基因突变也是T1DM的重要原因,这类糖尿病包括了许多遗传综合征(如Wolcott-Rallison综合征)和非遗传性糖尿病,如KCNJ11突变、ABCC8突变、胰岛素基因突变、葡萄糖激酶(glucokinase gene,GCK)突变、PDX1突变、PTF1A突变、GLIS3突变和FOXP3突变等。遗传与环境因素作用于胰岛自身免疫反应(表3),最终导致糖尿病。
表3 遗传与环境因素作用于胰岛自身免疫反应的差异
(三)体液免疫和细胞免疫
T1DM是一种由T淋巴细胞介导的,以免疫性胰岛炎和选择性胰岛β细胞损伤为特征的自身免疫性疾病。T细胞的中枢或周围耐受紊乱可能与自身免疫型糖尿病有关,胰岛素可能作为自身抗原触发自身免疫反应[14]。对HLA基因在T1DM发病中的作用提出了两个假说。
第一个假说与三元体复合物有关,假设T1DM的危险性由HLAⅡ类抗原与抗原肽结合决定,即在T细胞和抗原递呈细胞(以及和靶细胞)形成了一个以T细胞受体(TCR)、抗原肽和HLA为主要成分的抗原,即TCR-抗原-HLA三分子复合结构。在构成三元体的三类分子之间,即抗原-TCR、抗原-MHC以及MHC-TCR之间都出现了相互作用的结合部位、成分或活性中心。
三元体启动特异性免疫识别,最终激活T细胞,自身组织通过自身耐受使自身抗原所在靶组织免遭攻击和排斥,其中T细胞参与耐受的机制主要有三种:①克隆清除;②克隆失活或静止;③主动抑制。
第二个假说认为HLA具有与T1DM相同的背景,HLA与某种疾病有关联,但并不意味着携带某一抗原就一定患某病,HLA抗原一般不致病,而仅仅是一种遗传标志,HLA可能与某一有关基因相关联。环境因素在具有遗传易患性的人群中可能促进或抑制其自身免疫反应的作用。环境因素中的病毒感染、特殊化学物质以及可能的牛奶蛋白、生活方式及精神应激等与T1DM发病的关系较密切。与T1DM发病有关的病毒有风疹病毒、巨细胞病毒、柯萨奇B4病毒、腮腺炎病毒、腺病毒以及脑炎心肌炎病毒等,这些病毒多属于微小型病毒(picornavirus)(表4)。
表4 T1DM发病的环境因素
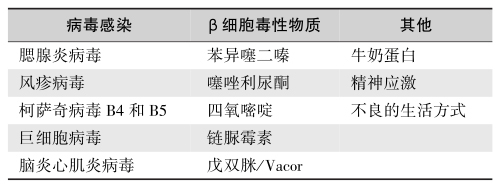
在环境和免疫因素中,病毒感染最为重要。很多病毒(柯萨奇病毒、腮腺炎病毒、脑炎心肌炎病毒、反转录病毒、风疹病毒、巨细胞病毒和EB病毒等)都可引起T1DM。病毒可直接破坏胰岛β细胞或激发细胞介导的自身免疫反应,从而攻击胰岛β细胞。进入体内的病毒立即被巨噬细胞吞饮,病毒蛋白残体和HLAⅠ类抗原均在巨噬细胞表面表达,故巨噬细胞就成为抗原递呈细胞。这种表达是致敏淋巴细胞识别的标记,T淋巴细胞被激活。
1.病毒感染致自身免疫反应
机制目前仍不清楚。Banm等研究发现胰岛自身抗原中的CPH与柯萨奇病毒的外壳蛋白及HLA-DQ3.2分子B链结构相似,因而提出T1DM发病的分子模拟理论(molecular mimicry)。该理论认为:当病毒与宿主蛋白质的抗原决定簇类似但又不完全相同时,不仅能激发交叉免疫反应,还能改变免疫耐受性,甚至导致自身免疫性疾病。后又有研究发现,柯萨奇病毒的B2-C蛋白与谷氨酸脱羧酶(GAD,一种胰岛细胞自身抗原)的部分片段氨基酸序列相似,因此认为某些病毒感染后所致T1DM可能通过上述分子模拟理论机制诱导自身免疫反应。但如使非肥胖糖尿病(NOD)小鼠感染淋巴性脑脉络炎病毒(LCMV)后则可消除自身免疫反应,理论上可用来预防T1DM,保护胰岛β细胞。
2.胰岛β细胞自身免疫损伤
激活的T淋巴细胞可能通过下列几个途径造成胰岛β细胞的自身免疫性损伤:①激活的T淋巴细胞增殖和分化,成为胰岛β细胞的细胞毒,破坏β细胞。②激活的T淋巴细胞使Th淋巴细胞分泌针对相应抗原的各种抗体。③激活的T淋巴细胞释放多种免疫因子,在β细胞自身免疫损伤中起重要作用。如白细胞介素-1(IL-1)能抑制β细胞分泌胰岛素;IL-1β可使一氧化氮(NO)和氧自由基的生成增加并损伤β细胞;肿瘤坏死因子(TNF)和γ干扰素两者的共同作用又诱导β细胞表面的HLAⅡ类抗原表达。同时,具有Ⅱ类抗原的巨噬细胞也成为β细胞自身组分的抗原递呈细胞,引起胰岛β细胞自身免疫性炎症的进一步恶化。经上述各种细胞因子和免疫因子的协同作用,胰岛β细胞被大量破坏,引发和加重糖尿病。
3.自身免疫导致T1DM
根据现有的研究结果,可认为T1DM是自身免疫性内分泌病,是一种发生于胰岛β细胞的器官特异性自身免疫病,体液免疫和细胞免疫都参与其病理过程。其主要依据如下:①T1DM与HLAⅡ类抗原(D区)相关联,Ⅱ类抗原与自身免疫疾病有关。②T1DM可同时伴发其他免疫紊乱性内分泌疾病,如慢性淋巴细胞性甲状腺炎、Graves病、特发性肾上腺皮质功能不全及其他免疫性疾病,如恶性贫血、重症肌无力和白癜风等。③T1DM家族成员中也患有自身免疫性疾病,如类风湿关节炎和系统性红斑狼疮等。④人类和动物T1DM早期胰岛有淋巴细胞浸润(免疫性胰岛炎),与其他自身免疫性疾病的淋巴细胞浸润相似。⑤在临床糖尿病发病前后的血清中存在自身免疫性抗体,如在Vacor中毒存活伴发糖尿病的患者、致糖尿病病毒感染后的患者以及由链脲霉素所制备的糖尿病大鼠体内均发现这些抗体。T1DM可有下列胰岛细胞自身抗原:谷氨酸脱羧酶(GAD),胰岛素,胰岛素受体,牛血清白蛋白,葡萄糖转运体,热休克蛋白65kD和52kD自身抗原,胰岛细胞抗原12kD、512kD、150kD和38kD自身抗原以及羧基肽酶H等,这些自身抗原可产生相应的自身抗体,如胰岛素抗体(IAA)、谷氨酸脱羧酶抗体(GAD抗体)、胰岛细胞抗体(ICA)、酪氨酸磷酸酶蛋白抗体(ICA512和IA-2)等。⑥免疫学指标如GAD抗体、ICA及IAA等对T1DM的发病有预测价值,特别是多种胰岛自身抗体的联合检测可增加对T1DM的预测价值。⑦免疫抑制剂能防止T1DM的发生。但是,世界各地均有大量报道,在T1DM中,有少数患者无体液免疫紊乱的依据(根据美国糖尿病协会的分类标准,这些患者称为1b型糖尿病)。经反复检查未能测出抗胰岛细胞抗体、抗胰岛素抗体和抗GAD抗体,抗甲状腺过氧化物酶(TPO)抗体、抗甲状腺球蛋白抗体、抗21-羟化酶抗体及抗胃壁细胞抗体等也均为阴性,其发病病因有待进一步研究。
细胞毒CD8+T细胞介导β细胞的杀伤过程,CD4+T细胞则协助维持细胞的反应性;巨噬细胞(Mθ)释放TNFα、IL1β和其他细胞因子,引起β细胞应激和细胞死亡。Mθ促进CD8+T细胞分化、胰岛炎症和β细胞应激,强化NK细胞与β细胞的相互作用,杀伤β细胞。此外β细胞在受到病毒感染后表达IFN,介导免疫反应,进一步增强NK细胞介导的杀伤作用(图2)。胰岛β细胞自饮(autophagy)是机体清除凋亡的细胞核其细胞残片的一种重要功能。胰岛素抵抗或出现其他病理情况时,β细胞的自饮活性增强,过度的胰岛β细胞自饮有可能导致糖尿病[12]。
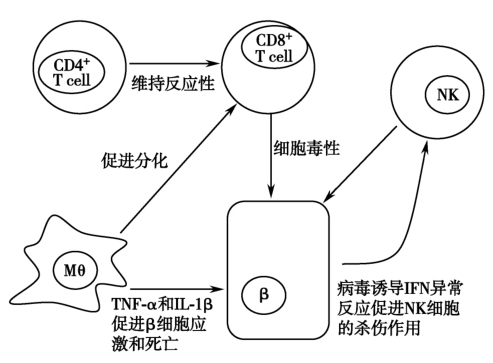
图2 参与T1DM发病的各种免疫细胞
细胞毒CD8+T细胞介导β细胞的杀伤过程,而CD4+T细胞协助维持细胞反应性; 巨噬细胞(Mθ)释放TNFα、IL1β和其他细胞因子,引起β细胞应激和细胞死亡,形成局部炎症;Mθ促进CD8+T细胞分化、胰岛炎症和β细胞应激,强化NK细胞与β细胞的相互作用,杀伤β细胞;β细胞在受到病毒感染后表达IFN,介导免疫反应,进一步增强NK细胞介导的杀伤作用
(四)自身免疫性胰岛损伤
1.病毒感染
已发现腮腺炎病毒、柯萨奇B4病毒、风疹病毒、巨细胞病毒、脑炎心肌炎病毒及肝炎病毒等与T1DM的发病有关。其发病机制可能是:①病毒直接破坏胰岛β细胞,并在病毒损伤胰岛β细胞后激发自身免疫反应,后者进一步损伤β细胞;②病毒作用于免疫系统,诱发自身免疫反应。在这些发病机制中,可能都有遗传因素参与,使胰岛β细胞或免疫系统易受病毒侵袭,或使免疫系统对病毒感染产生异常应答反应。病毒感染诱发自身免疫反应的机制可能与病毒抗原和宿主抗原决定簇的结构存在相同或相似序列有关[15-17]。
2.致糖尿病物质
对胰岛β细胞有毒的物质或药物(如Vacor、四氧嘧啶、链脲霉素和喷他脒等)作用于胰岛β细胞,导致β细胞破坏。如β细胞表面是T1DM的HLA-DQ易感基因,β细胞即作为抗原递呈细胞而诱发自身免疫反应,导致选择性胰岛β细胞损伤,并引发糖尿病。
3.饮食
蛋白质有报道认为,牛奶喂养的婴儿发生T1DM的风险高,可能是牛奶与胰岛β细胞表面的某些抗原相似所致。“分子模拟机制”认为,当抗原决定簇相似而又不完全相同时,能诱发交叉免疫反应,破坏免疫耐受性,激发自身免疫反应,甚至产生自身免疫性病变。牛奶蛋白只对携带HLA-DQ/DR易感基因的个体敏感,引发的自身免疫反应使胰岛β细胞受损,进而导致T1DM。Porch和Johnson等报道缺乏母乳喂养和食入过多牛奶与T1DM的发病率增高有关。Karjalainen等发现新发T1DM(142例)儿童血清中抗牛血清白蛋白(BSA)抗体增高。具有免疫原性的BSA抗体,只对具有HLA-DR或DQ特异性抗原易感基因的患者敏感,引发胰岛β细胞抗原抗体反应,致β细胞受损而引发T1DM。Savilahti等报道,芬兰706例新发T1DM患者中,105例7岁以下的患儿和456例3~14岁非T1DM同胞血清中有抗牛奶蛋白IgA、IgG抗体以及抗β-乳球蛋白(β-Ig)抗体。小于3岁的患儿,血清中IgA、IgG、β-Ig和IgG增高;大于3岁的患儿,血清IgA、β-Ig和IgG增高;患儿同胞中血清IgA增高,有14例为T1DM,故认为牛奶蛋白可激发T1DM患者的免疫反应而致病。牛血清白蛋白为牛奶的主要成分,其表位152~168氨基酸与HLAⅡ类分子抗原的 B链(DR和DQ)同源性高,它与胰岛β细胞表达的热休克蛋白间也有高度同源性。牛血清白蛋白表位ABBOS抗原与热休克蛋白69kD间相互作用,符合分子模拟理论。但迄今为止,牛奶蛋白作为T1DM的始发因素仍存在争论。
(五)自身免疫性β细胞凋亡
细胞凋亡在正常组织细胞死亡和一系列疾病中均起作用。在体外分离的大鼠β细胞和人类胰岛细胞肿瘤来源的β细胞株都有细胞凋亡的形态学改变。杀鼠药(rodenticide)制备的糖尿病模型可检测到β细胞的凋亡。T1DM动物模型NOD小鼠的β细胞凋亡研究发现,在雌性NOD小鼠(3周龄)即可检测到凋亡的β细胞,是最早的和唯一的细胞死亡方式,先于胰岛的淋巴细胞浸润,这表明β细胞凋亡在自发或诱发的T1DM发病中起着一定的作用,且可以用来解释临床显性糖尿病前有很长的糖尿病前期阶段。一般认为,细胞凋亡不产生免疫反应,但新近的资料提示β细胞凋亡与T1DM在免疫方面有一定关系:①凋亡细胞表面存在自身反应性抗原;②可活化树突细胞,引发组织特异性细胞毒T细胞的产生;③诱导自身抗体的生成。这说明,在特定条件下,生理性细胞凋亡也可诱发免疫反应。
糖尿病母亲分娩的婴儿发生糖尿病的概率为正常婴儿的2~3倍,此可能与体内的花生四烯酸、肌醇(内消旋型)和前列腺素代谢失常等有关。这些代谢紊乱使进入胎儿体内的葡萄糖增多,产生氧自由基,导致胎儿胰岛发育障碍。烟熏食品中含亚硝酸胺可能与T1DM的发生有关。应激可促使产生对抗胰岛素的激素,如生长激素、泌乳素、胰高血糖素和儿茶酚胺等,这些激素均可间接影响免疫调节功能和炎症反应,从而影响自身免疫病的发生。
因此目前认为,T1DM是一种以APC和T-细胞为介导的自身免疫性疾病,其特征有:①T1DM的发病依赖于T细胞(CD4+和CD8+)所表达的抗β细胞抗原反应;②CD8+T细胞是启动自身免疫反应所必需的,而激活的CD4+T细胞是引起T1DM所必需的;③前炎性细胞因子是β细胞凋亡的中介因子。
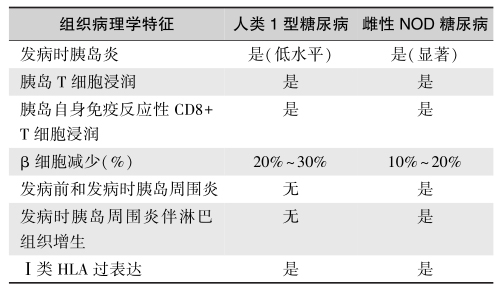
人类T1DM是由CD8+T细胞介导的细胞毒自身免疫病。自身免疫反应和胰岛炎针对胰岛β细胞,导致β细胞数目逐渐减少,最终造成慢性高血糖症。新发T1DM患者有胰岛炎的存在,NOD糖尿病小鼠模型的胰岛炎伴有显著白细胞浸润和淋巴细胞增生,而人类T1DM无此病变(表5)。但是,在糖尿病的治疗药物研究中,常采用NOD小鼠作为研究对象,因而许多动物实验认为有效的药物临床治疗无效。
表5 1型糖尿病患者与雌性NOD糖尿病小鼠的表型差异
胰岛β细胞破坏可分为两期:①启动期:环境因素在IL-1、TNF-α和IFNγ等免疫因子的介导下,启动胰岛β细胞损伤。②持续(扩展)期:若胰岛β细胞表面存在T1DM的抵抗基因,β细胞就不易成为抗原递呈细胞。相反,若存在易感基因,β细胞就很可能成为抗原递呈细胞,并将β细胞损伤后释放的抗原直接(或经巨噬细胞摄取和处理后)递呈给激活了的T淋巴细胞。活化的T细胞大量增殖,分化成细胞毒性细胞并释放多种细胞因子;其中IL-2可刺激B淋巴细胞产生特异性抗体,IFN-γ则激活自然杀伤细胞。在细胞介导的免疫应答进程中,胰岛β细胞作为自身抗原,导致选择性β细胞损伤,并形成恶性循环;当80%~90%的β细胞被破坏时,出现临床 T1DM(表6)。随着 T1DM进展,儿童T1DM患者发生自身免疫性甲状腺病的风险逐年增高,病程超过13年者的风险增加约18倍(表7和图3)。
表6 1型糖尿病的残存β细胞百分率
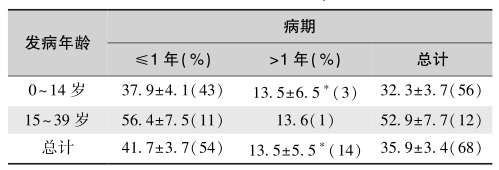
注:%表示胰岛素阳性细胞(均值%±SEM),括号内数值为检查病例数。∗P<0.01(非参数Mann Whitney检验)
表7 T1DM伴发的自身免疫性疾病
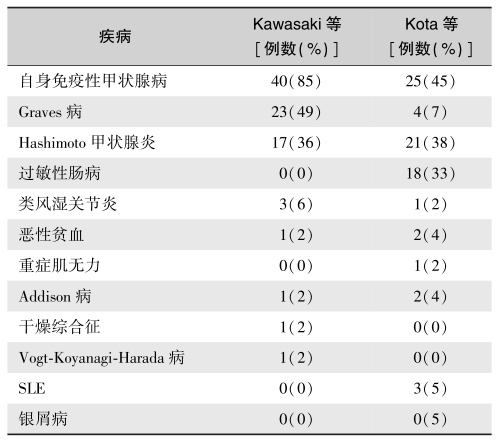
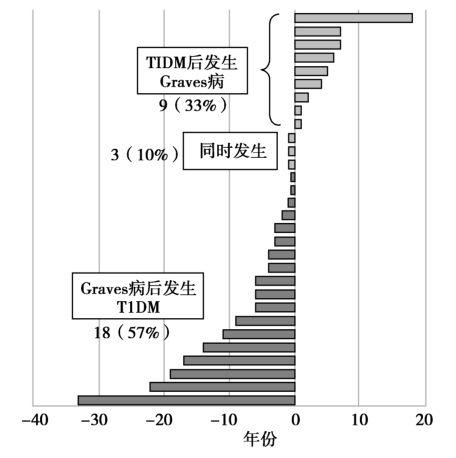
图3 APS3v患者T1DM并发Graves病的间隔时间
APS3v:变异3型自身免疫性多内分泌腺综合征
女,主任医师,硕士研究生导师。长期工作在临床一线,有丰富的临床经验。擅长肥胖、糖尿病、高尿酸血症、痛风、骨质疏松、继发性高血压以及甲状腺疾病等的诊治,特别是肥胖、糖尿病、痛风等慢病的营养治疗。
教授,国家代谢性疾病临床医学研究中心主任,糖尿病免疫学教育部重点实验室主任,糖尿病细胞治疗湖南省工程研究中心主任,内科学(内分泌与代谢病)国家重点学科带头人,教育部创新团队带头人。擅长糖尿病等代谢内分泌病的精准诊断与治疗。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系





 Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.