丙型肝炎(hepatitis C)是由丙型肝炎病毒(hepatitis C virus,HCV)引起的一种传染病,是输血后肝炎的主要病因。HCV感染全球流行,已经成为一个主要的公共卫生问题。丙型肝炎初期常无临床症状,70%~80%发展为持续性病毒血症与慢性肝炎、肝硬化,并与肝细胞性肝癌的形成有关。在丙型肝炎的发展过程中有很多因素影响疾病发展的结局,包括感染时患者的年龄、性别、感染方式、病毒基因型和亚型、病毒准种、血清病毒载量等。
近年来,丙型肝炎在临床治疗方面取得了巨大的进展。丙型肝炎的治疗除一般治疗外,应用有效的抗病毒治疗清除病毒,对阻断疾病的进展、防止HCV感染相关并发症和死亡具有重要意义。大量研究已经证实,抗病毒治疗能降低HCV患者相关疾病如肝硬化、肝癌的发生率和死亡率。丙型肝炎的抗病毒治疗经历了3个阶段,第一阶段为常规干扰素α单药治疗,第二阶段为常规干扰素联合利巴韦林治疗,第三阶段为聚乙二醇干扰素(pegylated interferon,PegIFN)联合利巴韦林治疗。总体持续病毒学应答(SVR)从最初的24%左右到现在的69%左右。最近两种NS3丝氨酸蛋白酶抑制剂的上市,可能预示丙型肝炎治疗进入了第4阶段。但PegIFN-α联合利巴韦林目前仍是我国最有效的标准治疗方案(standard of care,SOC)。
一、丙型肝炎抗病毒药物大盘点
(一)干扰素α
包括普通干扰素α和PegIFN-α。为提高干扰素的疗效,近年通过改变干扰素的结构,开展了新型干扰素的研究。新型干扰素主要有:
1.新型组合干扰素:重组甲硫氨酸组合干扰素1或称重组集成干扰素α注射液(consensus-interferon,CIFN)是由166个氨基酸组成的新型非天然Ⅰ型干扰素,其分子量为19.5kD,根据已知11种干扰素α亚型的氨基酸序列,筛选各序列等位点上出现频率最高的氨基酸,构建成合成重组互补DNA,转染给大肠埃希菌的表达产物。这种非天然重组组合干扰素与等当量成分的天然α-2a和α-2b干扰素比较,体外可增强自然杀伤细胞活性、抗病毒活性、抗增殖作用以及基因诱导活性,这可能与CIFN和Ⅰ型干扰素受体的亲和力较强有关。
早期的临床研究证实,9μg组与α-2b 300万单位组比较无显著差异。但是,天然干扰素或用9μg后复发者,用CIFN 15μg再治疗可获得较好效果;初次治疗无应答者,再用15μg治疗,虽可取得一定的效果,但是逊于复发组的再治疗。此外,CIFN对于高病毒负荷组和1b型病例均有较好的疗效。CIFN的不良反应与天然干扰素相似,15μg患者也能很好耐受。根据国内多中心的研究表明,CIFN 15μg组不论生化和病毒的应答均显著高于α-2a干扰素300万单位组。CIFN的疗效虽优于普通干扰素,但低于长效干扰素,现应用已不广泛。
2.清蛋白干扰素:清蛋白干扰素α-2b(Alb IFN-α-2b)是通过直接的基因融合产生,并且由多肽分子重组构成。在这种多肽分子中,治疗蛋白的氨基酸系列后面紧跟着清蛋白的氨基酸系列。Alb IFN-α-2b的半衰期较PegIFN更长,能每2周注射一次。在对初治患者所进行的Ⅱ期临床研究中,清蛋白干扰素α-2b联合利巴韦林治疗后的SVR率与PegIFN联合利巴韦林治疗后所引起的SVR率相当,但前者的剂量只有后者的一半。在对IFN无应答者中,清蛋白干扰素α-2b的SVR总的发生率为17.4%,而对PegIFN联合利巴韦林无应答的基因1型患者的SVR率为10.7%。但清蛋白干扰素治疗组中因不良事件导致停药的事件较PegIFN组增多,已停止临床试验。
3.干扰素ω:Novozheov等报道了干扰素ω单独给药或联合利巴韦林治疗基因1型慢性丙型肝炎的安全性、耐受性及抗病毒疗效(Ⅱ期研究)。研究中,102例受试者随机分组,单用干扰素ω治疗组有21/35例(60.0%)获得早期病毒学应答(EVR),联合治疗组有56/67例(83.6%)获得EVR。结果提示,干扰素ω耐受性较好,共有4例严重不良事件报道,最常见的导致减少剂量的事件为贫血和中性粒细胞减少。
(二)利巴韦林(ribavirin,RBV)
又名病毒唑、三氮唑核苷等,是广谱强效的抗病毒药物,目前广泛应用于病毒性疾病的防治。RBV增强干扰素抗HCV的机制尚不清楚,单独应用RBV对HCV几乎没有作用。国内人体生物利用度研究资料表明,RBV颗粒口服后吸收迅速,在60~90分钟内血药浓度可达到峰值。RBV进入体内后,经磷酸化生成具有活性的代谢产物——RBV单磷酸。消除半衰期约为24小时。RBV能滞留于红细胞内。主要由肾脏排泄,仅有少量随粪便排出。
(三)NS3/4A丝氨酸蛋白酶(NS3/4A SP)抑制剂
NS3/4A SP抑制剂根据其作用位点,可分为2类:可逆共价结合抑制剂和非共价结合抑制剂。NS3/4A SP可逆共价结合抑制剂是基于NS3/4A SP的底物设计的抑制剂。其抑制原理是利用不易被切割的底物类似物来竞争NS3/4A SP的反应中心,从而降低NS3/4A SP的活性,抑制病毒的复制。这类药物现在研究比较成熟的有特拉普韦和宝赛普韦。
1.特拉普韦(telaprevir,TVR):TVR是一种口服的拟肽类抑制剂,其主要作用于HCV基因1型。该药联合PegIFN-α-2a和RBV(P/R)治疗HCV基因1型感染的初治及再治患者3项Ⅲ期临床研究结果已发表,其疗效见图1。与原有标准的P/R治疗方案(SOC)相比,加用TVR(750mg,每日3次)的三联疗法,可将初治患者的SVR从4%提高至69%~75%。TVR已于2011年5月获美国FDA批准上市。推荐的治疗方案为,先用TVR联合P/R SOC的三联治疗12周,再根据既往治疗史及患者对12周三联治疗的反应(即RGT,应答指导的治疗),再继续使用P/R SOC 12~36周,所以全疗程为24~48周。TVR的主要不良反应有瘙痒、皮疹和贫血。
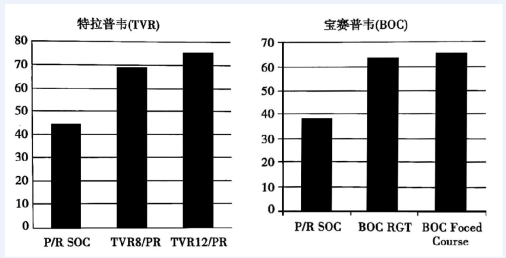
图1 特拉普韦(TVR)及宝赛普韦(BOC)三联疗法与P/R SOC在初治患者SVR率的比较
2.宝赛普韦(boceprevir,BOC):为2011年5月美国FDA批准上市的另一种直接抗HCV药物,也主要用于HCV基因1型治疗。该药联合PegIFN-α-2b及RBV(P/R)治疗HCV基因1型感染的初治及再治患者Ⅲ期3个临床研究结果见图1。与原有标准的P/R SOC相比,加用BOC(800mg,每日3次)的三联疗法,可将初治患者的SVR从38%提高至63%~66%。对既往SOC方案治疗无应答者三联疗法亦可获得23%~33%的SVR。与TVR不同的是,应用BOC与P/R SOC三联疗法的推荐治疗方案为:先用4周的P/R SOC导入期(lead-in phase)治疗,再于第5周加BOC,依既往治疗史及患者对治疗的反应,进行24~44周的三联治疗。部分患者完成所需的三联治疗后尚需12周的P/R治疗。所以,依据既往治疗史及患者对治疗的反应,BOC三联治疗的全疗程为28~48周。对参与上述研究的亚裔患者的进一步分析提示,亚裔患者对BOC三联治疗反应也高于对P/R SOC的SVR率。BOC治疗出现贫血等不良反应的比例比SOC标准治疗要高。
TVR和BOC单独使用数周即可检测到耐药变异,因此不宜单独使用,只能与SOC方案联合使用于:①提高SVR率;②SOC难以获得SVR的难治性患者;③在对标准治疗耐受性较差患者中,加用蛋白酶抑制剂可减低干扰素或RBV剂量,提高耐受性;④既往抗HCV治疗无应答或复发患者。对于IFN-α或RBV有禁忌证患者的治疗尚有待更多的直接抗病毒药(DAA)上市。
NS3/4A SP抑制剂正在进行Ⅰ期或Ⅱ期临床试验的有TM435350、R7227/ITMN-191、MK-7009、BI201335、Narlaprevir、BMS-650032和PHX1766。
(四)其他直接抗病毒药物
主要有NS5B多聚酶抑制剂、NS5A抑制剂、亲环素抑制剂、HCV受体拮抗剂、水飞蓟宾衍生物、thiazolide等。以NS5B核酸多聚酶抑制剂研究较多,并有多种药物显示较好的应用前景。
1.NS5B多聚酶抑制剂:包括核苷类NS5B多聚酶抑制剂和非核苷类NS5B多聚酶抑制剂。前者较有前景的有Valopicitable、R1626、R7128、IDX184、MK-0628,其中R7128已进入Ⅱ期临床试验。后者有Filibuvir、B1207127、MK-3281、VCH759、VCH916、VCH222、ANA598、GS-9190和ABT-333等,其中Filibuvir、B1207127已进入Ⅱ期临床试验。
2.NS5A蛋白抑制剂:NS5A蛋白存在干扰素敏感决定区,且研究表明NS5A对HCV的复制有调节作用。BMS-790052是第一个在研的NS5A蛋白抑制剂,初步研究表明,该药能迅速降低HCV RNA载量,已进入Ⅱ期临床试验。
3.IRES抑制剂:可抑制HCV多聚蛋白的翻译,现已知的IRES抑制剂包括反义寡核苷酸、小干扰RNA和核酶等。目前这类制剂的临床试验结果均不太理想。
(五)作用于宿主靶位的抗HCV药物
这类药物包括病毒入侵抑制剂如抗CD81抗体、靶向作用于宿主代谢药物如亲环素B抑制剂Debio-25以及作用于核受体的药物如PPAR受体的药物柚皮素(naringenin)等。
(六)胸腺素α(thymosin-α)
胸腺素α是由28个氨基酸构成的肽类免疫调节剂,能在体内和体外修饰免疫应答,增强细胞免疫。有关胸腺素α治疗丙型肝炎的研究很早就有开展,但各报道的病例数均较少,且缺乏高质量的随机对照研究。有限的研究表明,单一用于丙型肝炎,疗效并不理想。胸腺素α与干扰素α联合治疗比单用干扰素α能获得更高的ALT复常率和HCV RNA阴转率。对SOC方案治疗失败者加用胸腺素可获得一定的疗效。这种免疫调节剂与干扰素联合治疗似有一定的益处,但是也应注意到在诱导不良反应方面可能出现协同效应。
二、多采用短期临床指标 评价HCV感染者抗病毒疗效
大量临床研究表明,有效的抗病毒治疗可改善患者长期生存率。因此,抗病毒治疗的长期目标为减少HCV感染相关的肝硬化、肝衰竭与肝细胞癌发生率,降低HCV相关病死率,改善患者生活质量。但由于HCV感染患者病情进展缓慢,很难以长期目标来评价抗病毒疗效,因此,疗效评价多采用短期的临床指标,包括病毒学应答、生化学应答与肝组织学应答指标。其中病毒学应答指标中的SVR是当前评判疗效的最主要指标。常见的病毒学应答指标见表1。
表1 CHC抗病毒治疗病毒学应答指标

三、慢性HCV感染者抗病毒治疗 适应证与禁忌证为…
慢性HCV感染者抗病毒治疗的适应证与禁忌证见表2。需要说明的是,患者血清ALT水平不应作为是否进行抗病毒治疗的参考指标。另外,部分患者虽然肝脏组织学病变较轻,但随着年龄的增加,其对于抗病毒治疗的耐受性会逐渐降低;慢性HCV感染除导致肝脏疾病外,还可增加患者脂肪肝和糖尿病发病风险;且肝组织学病变轻微的患者进行抗病毒治疗同样能取得理想的疗效,对这部分患者也应该进行抗病毒治疗。急性丙型肝炎因慢性化率高,现在一般认为也应进行抗病毒治疗。
表2 CHC抗病毒治疗的适应证与禁忌证

四、不同基因型丙肝初治患者 抗病毒方案如何选?
基因型是影响CHC患者抗病毒治疗应答的最重要因素,不同基因型患者初治的抗病毒治疗以及随访方案见表3和表4。
表3 基因2与3型初治患者参考治疗方案

表4 基因1型及4~6型初治患者参考治疗方案

多项大型临床研究均表明,PegIFN联合RBV的方案疗效优于普通IFN联合RBV方案。而且PegIFN仅需每周注射一次,方便患者用药并有利于增加患者依从性。目前PegIFN联合RBV的方案被认为是丙型肝炎抗病毒治疗的“标准方案”。在条件允许下,应推荐患者采用PegIFN联合RBV的方案治疗,尤其是对于基因1型和/或高HCV RNA载量的患者。
急性丙型肝炎患者应该接受干扰素为基础的抗病毒治疗。但治疗可推迟到急性起病后的8~12周进行,以观察有无自发性恢复。对急性丙型肝炎单用普通干扰素治疗往往也可取得较好的疗效,但聚乙二醇干扰素疗效更好,使用更方便。其最佳疗程尚待确定,但是至少应治疗12周,也可考虑治疗24周。对于加用或者不用RBV目前尚无一致意见,因此,应根据个案情况来决定。
五、抗病毒治疗的疗效预测因素与个体化治疗方案调整
(一)与疗效相关的因素
影响疗效的因素很多,可分为病毒因素、宿主因素和药物因素。
1.病毒因素:主要是病毒基因型和病毒载量,也是研究最多的疗效影响因素。基因1型,特别是1b型对干扰素的应答较差。McHutchison等(1998)观察了RBV与α-2b干扰素联合和单独干扰素治疗初次接受治疗的基因1型和2、3型HCV感染者的结果,结果表明有明显的差异,经过6个月联合治疗的2型和3型患者,几乎70%获得持续性应答效果,而在1型患者仅有30%获得持续性应答。对于联合PegIFN和RBV的标准治疗方案(SOC),基因型同样是最强的疗效预测指标之一。对1型患者,SOC方案治疗48周,其SVR为40%~54%,2型或3型患者治疗24周即可获得65%~82%的SVR。最近的一项研究表明,2型患者的SVR稍高于3型患者(74% vs 69%)。
治疗前病毒载量是预示干扰素疗效的另一重要因素,较低者(小于2×106拷贝/ml)疗效好,其持续应答率也高,可达到62%。
除上述两病毒因素外,HCV准种和干扰素敏感决定区也与抗病毒疗效相关。
2.宿主因素:下列宿主因素有利于取得SVR:①年龄<40岁;②女性;③感染HCV时间短;④肝脏纤维化程度轻;⑤对治疗的依从性好;⑥无明显肥胖者;⑦无合并HBV及HIV感染者。
近来发现IL-28B基因上游序列的多态性与患者对PegIFN+RBV方案应答相关。IL-28B又名IFN-λ3,目前已公布的三项全基因组关联分析表明,IL-28B基因多态性与基因1型慢性丙型肝炎对SOC的应答密切相关。IL-28B rs1297860有3个等位基因表型,即C/C、C/T、T/T。其中C/C型者应答较好,分析表明该指标是比病毒载量、肝纤维化程度更强的SVR独立预测因素。因中国汉族HCV感染者93.4%为C/C型,故疗效优于欧美人群。研究还发现,C/C型患者在急性感染时自发清除病毒的概率也明显高于C/T和T/T型者。甚至有专家建议应根据IL-28B基因型将1型HCV分为两群:①高应答型,可采用与基因2或3型相同的治疗方案;②低应答型,可能需联合直接抗病毒药治疗。
近年来研究发现,血清素、胰岛素抵抗是慢性丙型肝炎抗病毒治疗获得SVR的独立预测因子;IFN联合RBV在ALT正常或升高的患者中疗效相似,故基线ALT水平与SVR关系不明显。肝脏及血清铁蛋白水平也对疗效有一定影响,水平高者疗效差。
干扰素抗体:干扰素抗体分中和抗体和结合抗体。前者可以与干扰素的生物活性位点结合,从而使干扰素失去作用;后者不影响干扰素活性。影响干扰素抗体产生的因素除与宿主的免疫状态有关外,也与干扰素的种类、剂量、疗程有关。
3.药物因素:干扰素的种类和剂量与疗效相关,PegIFN疗效优于普通干扰素,而PegIFN-α-2a与α-2b之间的疗效并无明显差别。干扰素的剂量与疗效密切相关,剂量不足将影响最终SVR率。RBV剂量也影响SVR,一般要求至少维持80%的标准剂量。
(二)个体化治疗方案
每一个患者的情况不同,治疗方案也有所不同,如对于基因1型、高HCV RNA载量和/或高体重的患者应更加倾向于推荐PegIFN联合RBV治疗;在经验丰富的专业医师指导下,与患者充分沟通,并在患者可耐受的情况下,部分患者应当根据患者治疗过程中病毒应答情况与耐受情况,在标准疗程的基础上延长患者疗程、调整RBV和/或IFN的剂量。
根据患者治疗过程中病毒学应答情况来预测患者的疗效,并相应调整治疗方案,即所谓的应答指导治疗(response-guided therapy,RGT),成为抗病毒治疗的研究热点。目前对SVR预测价值最高的病毒学应答预测指标为RVR和EVR(包括cEVR与pEVR)。
研究表明,IFN抗HCV治疗的前4周可分为两个时相,治疗的24~48小时为快速时相,此阶段IFN阻断病毒产生和释放、清除血液中病毒,并且疗效呈剂量依赖性;第2~28天为第二时相,此阶段由IFN促进机体免疫系统发挥作用,清除病毒感染细胞。因此,治疗4周后HCV RNA阴转在一定程度上可反映机体具有较强的清除HCV感染能力,这也奠定了以RVR预测患者最终SVR的理论基础。同时这也提示在患者初始治疗时应尽可能采用足量的IFN联合RBV进行治疗。临床研究证实,RVR对于患者SVR具有强预测作用,且其预测意义不受患者HCV基因型影响。在基因1型获得RVR的患者中,最终有89%患者获得SVR;在基因2与3型患者中,70%~95%患者达到SVR;在基因4型患者中,86%患者达到SVR。基于RVR对于SVR的预测价值,有研究建议,将基因1与4型获得RVR的患者疗程缩短为24周,或将基因2与3型患者的疗程缩短为16~18周。但考虑到相关研究结果尚存在争议,且尚无基于我国患者人群的研究数据,因此建议,除非患者不能耐受标准疗程的治疗,应慎重缩短获得RVR患者的治疗疗程。
EVR的预测价值在于,未达到EVR患者仅有极小概率获得SVR。有研究表明,未达到EVR的基因1型患者仅有3%达到SVR。因此,基因1型患者,如治疗12周HCV RNA下降<2log10 IU/ml(拷贝/ml),应与患者充分沟通进一步的治疗方案,终止治疗或调整治疗,即在经验丰富的医师指导下,在患者知情同意并可耐受的情况下,延长治疗疗程、调整RBV和/或IFN的剂量。其中,对于未达到cEVR并于治疗24周前实现HCV RNA阴转的患者,多项研究均表明,此类患者延长24周疗程可显著提高SVR率。因此,治疗12周与24周期间实现HCV RNA阴转的基因1与4型患者,可考虑延长疗程至72周;而基因2与3型患者可延长疗程至48周。
六、丙型肝炎特殊人群 抗病毒治疗如何选择?
(一)治疗无应答或复发患者的再治疗
慢性丙型肝炎复发是指治疗结束时HCV RNA低于检测下限(50IU/ml),但在停药后24周随访期内HCV RNA复阳(即达到ETVR却未获SVR)。HCV抗病毒治疗无应答或复发患者,确定再治疗方案前应首先充分了解既往抗病毒治疗情况,分析导致无应答或复发的可能原因,包括所应用药物的类型、剂量、给药途径、疗程及治疗期间的病毒应答情况;同时要了解患者的治疗依从情况;患者是否嗜酒和静脉吸毒等。
初次单用普通IFN-α治疗后复发或无应答的患者,可采用PegIFN或普通IFN-α联合RBV的参考方案再次治疗;初次应用普通IFN联合RBV无应答或复发的患者,可使用PegIFN联合RBV的参考方案进行治疗。采用PegIFN联合RBV的标准方案治疗无应答的患者再次应用相同方案治疗,仅有<5%患者可获得SVR,此类患者更换IFN种类是否有效仍无统一意见。
PegIFN联合RBV的标准方案治疗后复发的患者,重复以前治疗方案,仍可获得一定SVR(38%),再治疗是将疗程延长至72周,SVR率可明显提高(58%)。认真分析复发原因,尽量避免引起复发的因素,对预防再次复发至关重要。因此,此类患者应当在更换治疗方案后按照病毒学应答情况进行个体化治疗。
(二)丙型肝炎肝硬化患者的抗病毒治疗
有效的抗病毒治疗可降低肝硬化患者相关并发症发生率,延长患者生存时间,并改善患者生活质量。因此,虽然此类患者抗病毒治疗的SVR率低于肝组织学无肝硬化患者,但仍应对符合治疗指征的患者进行抗病毒治疗。
丙型肝炎肝硬化患者抗病毒治疗指征主要根据肝功能情况进行区分:Child-Pugh评分<7或终末期肝病模型评分(model for end-stage liver disease,MELD)<18者强烈推荐治疗,Child-Pugh为8~11或MELD评分为18~25应当选择病例治疗,而Child-Pugh评分>11或MELD评分>25不推荐治疗。需要明确的是,患者肝功能评分处于动态变化过程。评分差的患者经过治疗后可得到一定程度的改善。因此,对当时未达到评分的患者可先积极改善肝功能治疗,再进行抗病毒治疗。
由于肝硬化患者常伴有外周血白细胞计数或血小板计数下降,因此,在治疗初始,往往不能接受足量的抗病毒治疗剂量。对于此类患者,可考虑在密切观察的情况下逐渐加量,达到临床能耐受的抗病毒治疗剂量,以尽可能完成治疗的疗程。
(三)肝移植后丙型肝炎复发的抗病毒治疗
肝移植前未进行有效抗病毒治疗的CHC患者,移植后丙型肝炎5年复发率为90%,因再感染者5年内移植肝发生肝硬化的比率为25%~30%。对此,最有效的预防手段是在移植前通过抗病毒治疗将血液中的HCV RNA降至最低。肝移植前未能有效抗HCV治疗的患者,在肝移植后应密切观察,如出现HCV RNA阳性,伴有不能以其他原因解释的ALT持续升高或肝活检显示移植肝出现显著纤维化,应考虑抗病毒治疗。但由于肝移植后患者多同时应用高剂量的免疫抑制剂,全血或部分血细胞水平下降以及存在肾功能损伤等问题,仅有40%~60%患者可耐受抗病毒治疗。另外,抗病毒治疗还可增加移植排斥反应的风险。因此,此类患者抗病毒治疗应在有丰富经验的肝移植医师与肝病学医师的共同监督下进行。患者抗病毒治疗方案应选择PegIFN,再根据患者耐受情况选择加用或不加用RBV。治疗剂量应当从小剂量开始,无严重不良反应时逐渐增加剂量;即便如此,应密切监测并及时处理抗病毒治疗的不良反应;密切关注患者是否存在移植排斥反应的迹象,一旦发现应及时停药。
(四)CHC合并肾脏疾病患者的治疗
所有慢性肾病等待肾脏替代疗法(包括血液透析或者肾移植)的患者都应该进行HCV筛选以便于管理与治疗。CHC合并肾脏疾病患者的治疗主要包括两种情况:①HCV感染引起的肾脏损害,最常见的是冷球蛋白血症相关性肾小球肾炎;②CHC合并慢性肾脏疾病患者的抗病毒治疗。
HCV感染继发的冷球蛋白血症唯一有效的治疗即为抗病毒治疗,有效的抗病毒治疗可使冷球蛋白血症消失,肾脏损害也可有效缓解,因此,该类患者存在抗病毒治疗的必要性。但由于IFN本身有可能加重患者肾脏内血管炎病变,并导致肾功能恶化,因此,目前此类患者的治疗指征为存在明显的冷球蛋白血症症状、轻到中度蛋白尿并且肾功能损害进展缓慢的患者。治疗方案选择IFN联合RBV治疗,自小剂量开始,无严重不良反应时逐渐增加剂量,并密切关注患者肾功能改变。具有冷球蛋白血症以及严重蛋白尿、快速进展肾病表现,或者冷球蛋白血症急性复发的患者,可以应用利妥昔单抗、环磷酰胺联合甲泼尼龙,或者血浆置换治疗,在急性过程缓解后可以继续以干扰素为基础的治疗。
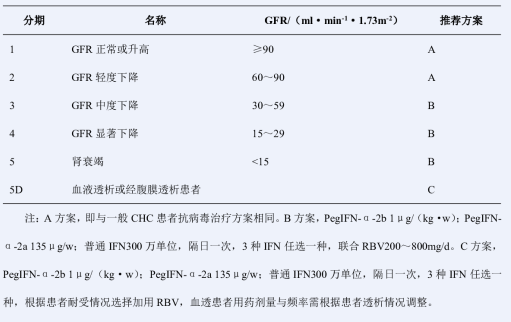
CHC合并肾脏疾病患者的抗病毒治疗至少需要注意3点:①抗病毒治疗初始时应详细评估导致慢性肾脏损害的基础疾病,如原发性高血压、糖尿病等是否已得到控制,并明确是否存在治疗禁忌证;②由于IFN(包括普通IFN与PegIFN)和RBV均经过肾脏代谢,应根据患者肾小球滤过率(glomerular filtration rate,GFR)情况决定患者是否可以治疗以及治疗剂量的调整;③慢性肾病患者一般情况往往较差,存在不同程度的肾性贫血,且现有研究表明,相当比率的患者不能完成疗程,治疗后复发率较高,在开始治疗前应与患者充分沟通,并密切监测不良反应。
CHC合并肾脏疾病患者的抗病毒治疗药物选择方案与疗程可参考一般CHC患者,但应根据患者GFR来调整药物剂量,剂量调整方案见表5。患者治疗应在经验丰富的肝病医师指导下进行,对于GFR<60ml/(min•1.73m2)的患者,需从小剂量开始应用,逐渐加量。需血液透析的患者,开始抗病毒治疗应更加谨慎,需要与经验丰富的肾脏病医师密切配合,根据患者血液透析的类型与频率来调整治疗方案。
表5 慢性肾脏疾病患者抗HCV治疗药物剂量调整方案
慢性HCV感染以及严重肾病而未进行血液透析的患者,可采用减量的聚乙二醇干扰素(α-2a每周135μg;α-2b每周lμg/kg)以及RBV(每天200~800mg)治疗,并严密监测不良反应;正在透析的HCV感染者的治疗,可以考虑普通干扰素(α-2a或者2b)3MU每周3次或减量的聚乙二醇干扰素(2a每周135μg或2b每周1μg/kg)。RBV在减量的情况下可以与干扰素联合应用,并密切观察贫血及其他不良反应。对慢性HCV感染但已行肾脏移植的患者不推荐治疗,除非出现了淤胆性肝炎。
(五)儿童和老年丙型肝炎的治疗
有关儿童慢性丙型肝炎的治疗经验尚不充分。初步临床研究结果显示,IFN-α单一治疗的SVR率似高于成人,对药物的耐受性也较好。65岁或70岁以上的老年患者原则上也应进行抗病毒治疗,但一般对治疗的耐受性较差。
(六)嗜酒及吸毒者
慢性酒精中毒及吸毒可能促进HCV复制,加剧肝损害,从而加速发展为肝硬化甚至HCC的进程。由于嗜酒及吸毒患者对于抗病毒治疗的依从性、耐受性和SVR率均较低,因此,治疗丙型肝炎必须同时戒酒及戒毒。
(七)合并HBV或HIV感染者
合并HBV感染会加速慢性丙型肝炎向肝硬化或HCC的进展。对于HCV RNA阳性/HBV DNA阴性者,先给予抗HCV治疗;对于两种病毒均呈活动性复制者,建议首先以IFN-α加RBV清除HCV,对于治疗后HBV DNA仍持续阳性者可再给予抗HBV治疗。对此类患者的治疗尚需进行深入研究,以确定最佳治疗方案。
在HIV高流行地区,HV和HCV混合感染常见,据估计,全世界有HIV/HCV混合感染者400万~500万例。合并HIV感染也可加速慢性丙型肝炎的进展,抗HCV治疗主要取决于患者的CD4+细胞计数和肝组织的纤维化分期。免疫功能正常、尚无即刻进行高活性抗反转录病毒治疗(HAART)指征者,应首先治疗HCV感染;正在接受HAART治疗、肝纤维化呈S2或S3的患者,需同时给予抗HCV治疗,但要特别注意观察RBV与抗HIV核苷类似物相互作用的可能性,包括乳酸中毒等;对于严重免疫抑制者(CD4+阳性淋巴细胞<2×108/L),应首先给予抗HIV治疗,待免疫功能重建后,再考虑抗HCV治疗。但CD4+细胞恢复到什么水平开始抗病毒治疗并无一致意见。混合感染者抗HCV疗效与CD4+计数有关,高者疗效好。
七、丙型肝炎抗病毒治疗常见的不良反应及处理
RBV的不良反应和处理:IFN联合RBV抗病毒治疗中约有1/3患者出现不同程度的贫血,主要原因为RBV引起的红细胞破坏增加。最近报道,ITPA基因的变异可显著影响RBV所致贫血,ITPA基因变异导致肌苷三磷酸激酶缺陷,从而抵抗由RBV治疗丙型肝炎引起的溶血性贫血发生。rs1127354的CC型和rs7270101的AA型较易发生RBV相关贫血。贫血常于用药1~3周后出现。当血红蛋白下降到85~100g/L时,需减少RBV剂量,当低于85g/L时则需要停用RBV。RBV用量对患者能否获得SVR具有重要意义,应尽可能保证患者足量完成疗程。血红蛋白的减低可使用红细胞生成素治疗,特别是对曾进行治疗但因停止RBV使用而失败者。在对症治疗无效的情况下才考虑降低RBV剂量,每次减量可以200mg/d的幅度递减。要避免过早和过度减量,从而将药物减量对抗病毒疗效的影响降至最低。
八、丙型肝炎的其他治疗
1.一般治疗:丙型肝炎的一般治疗,肝纤维化和肝硬化的治疗,癌变后的治疗与其他病因所引起的相应改变的治疗无特殊之处。肝外表现的治疗也应以抗病毒治疗为主,同时根据相应的损害和临床表现进行相应的内科治疗。
2.肝脏移植:肝脏移植的适应证是致命性肝硬化和肝硬化基础上的肝细胞性肝癌,伴有肝硬化的患者出现合并症,如反复出现腹水、Child-Pugh C肝硬化、难以控制的消化道出血、严重脑病以及细菌性腹膜炎等,若不作肝脏移植,其预期生存期只有1~2年。肝硬化基础上的肝细胞性肝癌,如果只有1~2个3cm大的结节,无肝外扩散,也应考虑肝脏移植治疗。肝脏移植后HCV再感染非常常见,在3年后约50%的患者出现移植器官感染或伴轻度病变,45%有慢性肝炎,只有5%的患者发展成严重病变,HCV相关肝硬化5年存活率约为10%。
肝脏移植的5年和10年存活率为70%以及60%,这是可以与其他非恶性肝病移植患者相媲美的。但是,应告知患者HCV复发的危险性和其移植前可能出现的后果。
参考文献
[1] Ghany MG, Strader DB, Thomas DL,et al. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology,2009,49(4):1335-1374.
[2] Lechmann M, Liang TJ. Vaccine development for hepatitis C. Semin Liver Dis,2000,20(2): 211-226.
[3] Backus LI, Boothroyd DB, Phillips BR, et al. A sustained virologic response reduces risk of all-cause mortality in patients with hepatitis C. Clin Gastroenterol Hepatol, 2011,9(6):509-516.
[4] Tian D, Yang D, Wang W, et al. Extrahepatic and intrahepatic replication and expression of hepatitis C virus. J Tongji MedUniv,1998,18(3):149-152.
[5] Singal AK, Singh A, Jaganmohan S, et al. Antiviral therapy reduces risk of hepatocellular carcinoma in patients with hepatitis virus-related cirrhosis. Clin Gastroenterol Hepatol,2010,8(2):192-199.
[6] 汪桦,薛小平,雷迎峰. HCV NS3/4A丝氨酸蛋白酶和NSSB RNA聚合酶抑制剂的临床研究进展.世界华人消化杂志,2009,17(25):2595-2600.
[7] Wagoner J, Morishima C, Graf TN, et al. Differential in vitro effects of intravenous versus oral formulations of silibinin on the HCV life cycle and inflammation. PLoS One, 2011,6(1):e16464.
[8] Jacobson IM, Cacoub P, Dal Maso L, et al. Manifestations of chronic hepatitis C virus infection beyond the liver. Clin Gastroenterol Hepatol, 2010, 8(12):1017-1029.
[9] 姜雪强,邹小静,田德英.聚乙二醇干扰素α-2a联合利巴韦林治疗慢性丙型肝炎患者的病毒学应答.临床肝胆病杂志,2011,27(4):419.
[10] Lee MH, Yang HI, Lu SN, et al. Hepatitis C virus seromarkers and subsequent risk of hepatocellular carcinoma: long-term predictors from a community-based cohort study. Clin Oncol,2010,28(30):4587-4593.
[11] 王平,田德英,张东绅,等.慢性丙型肝炎血清IL-2、TNF及丙肝病毒基型与干扰素疗效的关系.同济医科大学学报,2000,29(2):168-170.
[12] 成军,张锦前.丙型肝炎病毒感染与脂肪性肝病.中华肝脏病杂志,2009(11):804-806.
[13] McHutachison JG, Everson GT, Gordon SC, et al. Telaprevir with peginterferon and ribavirin for chronic HCV genotype infection. N Engl J Med,2009,360(18):1827-1838.
[14] Kwo PY, Lawitz EJ, MeCone J, et al. Efficacy of boceprevir, an NS3 protease inhibitor, in combination with peginterferon alfa-2b and ribavirin in treatment-naive patients with genotype hepatitis C infection(SPRINT-1) an open-label, randomised, multicentre phase 2 trial. Lancet, 2010, 376(9742):705-716.
[15] European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol, 2011, 55(2): 245-264.
[16] Hwang SJ, Lee SD. Hepatic steatosis and hepatitis C: Still unhappy bedfellows? J Gastroenterol Hepatol, 2011, 26 Suppl 1:96-101.
[17] Ghany MG, Nelson DR, Strader DB. et al. An update on treatment of genotype chronic hepatitis virus infection: 2011 practice guideline by the American Association for the Study of Liver Diseases. Hepatology, 2011, 54(4): 1433-1444.
[18] Kegin Hu. A clinician's handbook of digestive and liver diseases. SLACK Incorporated, 2012: 237-244.
男,主任医师、副教授,医学博士、博士生导师。从医近30年。擅长于内科感染性疾病、各种肝脏疾病、病毒性肝炎 、肝硬化 、脂肪肝、腹泻性疾病、发热性疾病及其他感染性疾病和寄生虫病的诊断和治疗。在长期的工作中积累了丰富的临床经验。
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
来源:人民卫生出版社《临床知识》约稿
作者:杨道锋教授,华中科技大学同济医学院附属同济医院感染科主任医师;田德英,胡克勤
编辑:环球医学资讯常路






 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
