毋庸置疑,分子靶向治疗及免疫治疗研究是肝细胞癌(hepatocellular carcinoma,HCC)最近几年及未来很长一段时间最热的治疗探索领域。从2007年索拉非尼成为进展期HCC的一线治疗药物以来,经过十余年的探索,2018年,仑伐替尼成为中国第二个获批的进展期HCC一线治疗药物。2017年和2018年,纳武利尤单抗和帕博利珠单抗分别获得美国食品药品监督管理局(FDA)批准HCC二线治疗,开启免疫治疗的新时代。
2017年以后开启HCC的二线治疗:瑞戈非尼在中国获批用于索拉非尼耐药后的晚期HCC、卡博替尼和雷莫芦单抗获得美国FDA审批用于HCC二线治疗;2019年,IMbrave150(免疫+抗血管靶向治疗)达到无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)主要研究终点,打破了分子靶向治疗在晚期一线HCC治疗的格局;2020年3月,卡瑞利珠单抗HCC适应证获批上市,是首个在中国获批HCC适应证的PD-1/PD-L1单抗。HCC发病机制探索及治疗发展历程见图1。
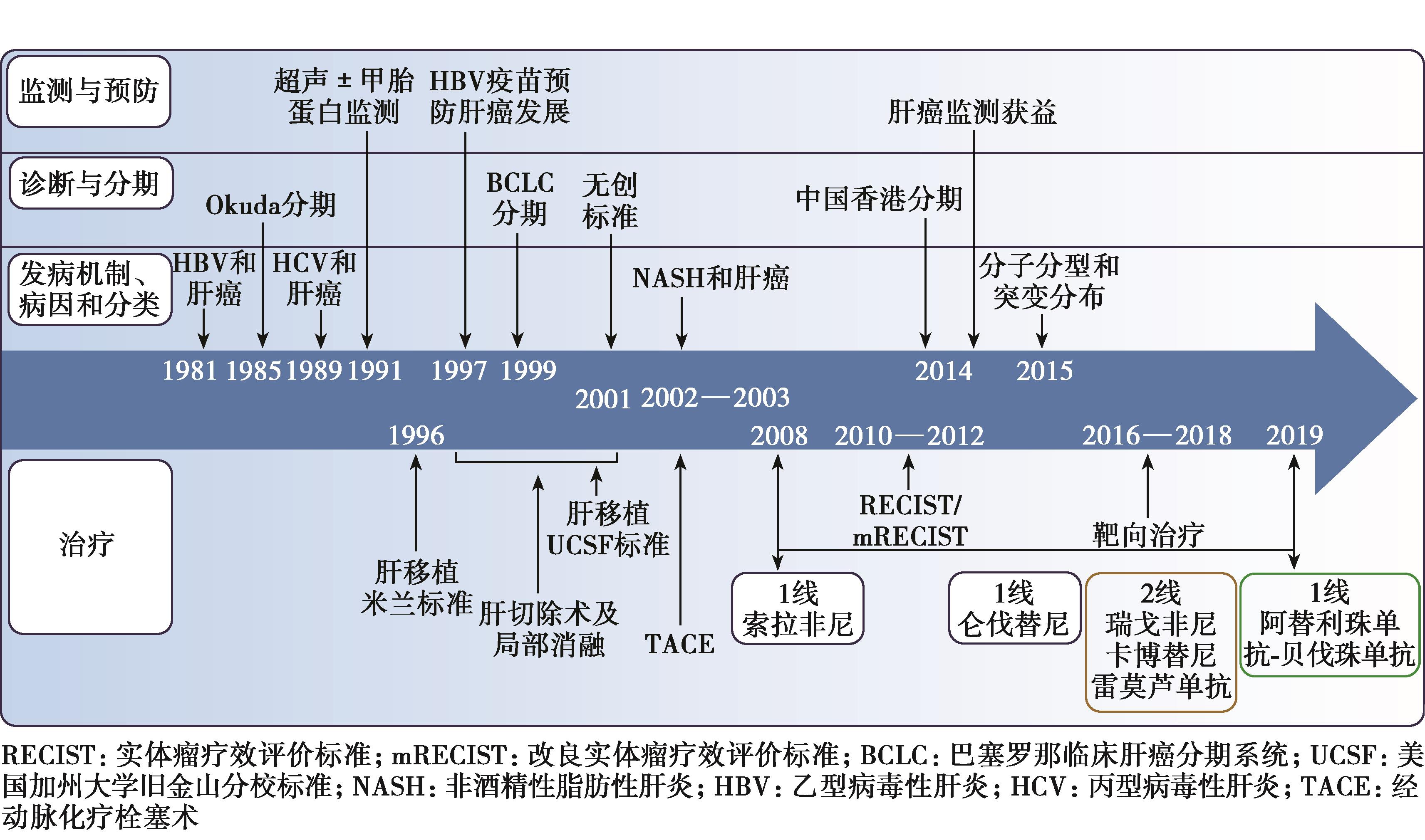
图1 HCC发病机制探索和治疗的历程
一、HCC分子靶向药物
(一)分子靶向药物一线治疗进展
1.索拉非尼
索拉非尼是一种口服的多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),具有抗肿瘤细胞增殖及抗血管生成的作用。美国FDA基于SHARP试验的结果,于2007年批准索拉非尼用于不可切除HCC的治疗,这也是首个被批准用于不可切除HCC治疗的分子靶向药物。索拉非尼获批后10年时间内尽管分子靶向治疗蓬勃发展,但多种分子靶向药物对比索拉非尼的研究均以失败告终:5项全球Ⅲ期临床研究(舒尼替尼、布立尼布、Linifanib、厄洛替尼联合索拉非尼,索拉非尼联合多柔比星对比索拉非尼)均未能证实OS不劣于或优于索拉非尼。近期的TACTICS研究表明,TACE联合索拉非尼较单独TACE治疗显著延长PFS(25.2 vs 13.5个月,HR=0.59,95%CI:0.41~0.87)。该研究设计是TACE术前2~3周使用索拉非尼400mg/d,围手术期暂停4日,耐受良好的病人可以每日2次口服索拉非尼400mg。按需进行TACE。研究双终点为PFS和OS。该研究的关键是不采用RECIST评价标准,肝内新发病灶不评估为疾病进展(progressive disease,PD),这样就延长了索拉非尼的使用时间。TACE术前使用索拉非尼有助于肿瘤血管的正常化,提升TACE疗效。联合应用有助于TACE治疗次数的减少,保护肝功能,延长病人的疾病进展时间(time to progression,TTP)。该研究是世界首个索拉非尼联合TACE取得阳性结果的研究,同时该研究提出采用至TACE进展时间(time to TACE progression,TTTP)作为TACE相关的TTP,采用TACE相关的PFS和TTTP作为OS的替代指标是此类研究合理的设计。同时,对于伴有微血管侵犯和门静脉癌栓高危复发风险因素的病人,索拉非尼可作为术后辅助治疗的选择之一。2019年ESMO Asia公布的荟萃分析纳入589例HCC病人,分析结果显示术后接受索拉非尼治疗的病人,相较于手术组能够显著降低肿瘤复发率,延长病人总生存期。索拉非尼目前被推荐用于Ⅱb期~Ⅲb期的HCC病人,位列《原发性肝癌诊疗规范(2019年版)》一线系统治疗的首位,作为经历了10年历史的进展期HCC的一线药物,地位仍然无法撼动。
2.仑伐替尼
仑伐替尼是另一个具抗血管生成活性的多靶点酪氨酸激酶抑制剂,也是血管内皮生长因子受体1-3、成纤维细胞生长因子受体1~4、血小板衍生生长因子受体α、RET及KIT的口服抑制剂(图2)。仑伐替尼批准用于不可切除HCC的治疗,包括晚期HCC或局部治疗后疾病进展的病人。REFLECT研究是10年来第一个试验结果为阳性的Ⅲ期、全球、随机、开放标签、非劣效性研究。最终研究结果显示,仑伐替尼组病人的中位生存期为13.6个月(95%CI:12.1~14.9),索拉非尼组为12.3个月(95%CI:10.4~13.9),研究达到非劣效终点(HR=0.92,95%CI:0.79~1.06),亚组分析中,观察到一致的研究结果。
(二)分子靶向药物二线治疗进展
1.瑞戈非尼
瑞戈非尼是一种口服多靶点酪氨酸激酶抑制剂,可抑制VEGF受体、血小板衍生的生长因子受体β和成纤维细胞生长因子受体1等血管生成激酶以及KIT、RET和B-RAF等突变的致癌激酶。全球RESORCE研究结果显示,瑞戈非尼用于索拉非尼治疗后出现进展的HCC病人,可以显著改善病人的OS(mOS 10.6个月 vs 7.8个月,P<0.000 1)。与对照组相比,瑞戈非尼组病人死亡风险显著降低38%,且安全性良好。索拉非尼-瑞戈非尼组自索拉非尼治疗开始的中位总生存期优于索拉非尼-安慰剂组(26.0个月 vs 19.2个月),这一结果表明接受一线和二线系统治疗病人的中位生存期可超过2年。瑞戈非尼作为首个获批用于索拉非尼治疗中出现影像学进展的不可切除性HCC二线治疗的药物,可显著改善病人的总生存期。
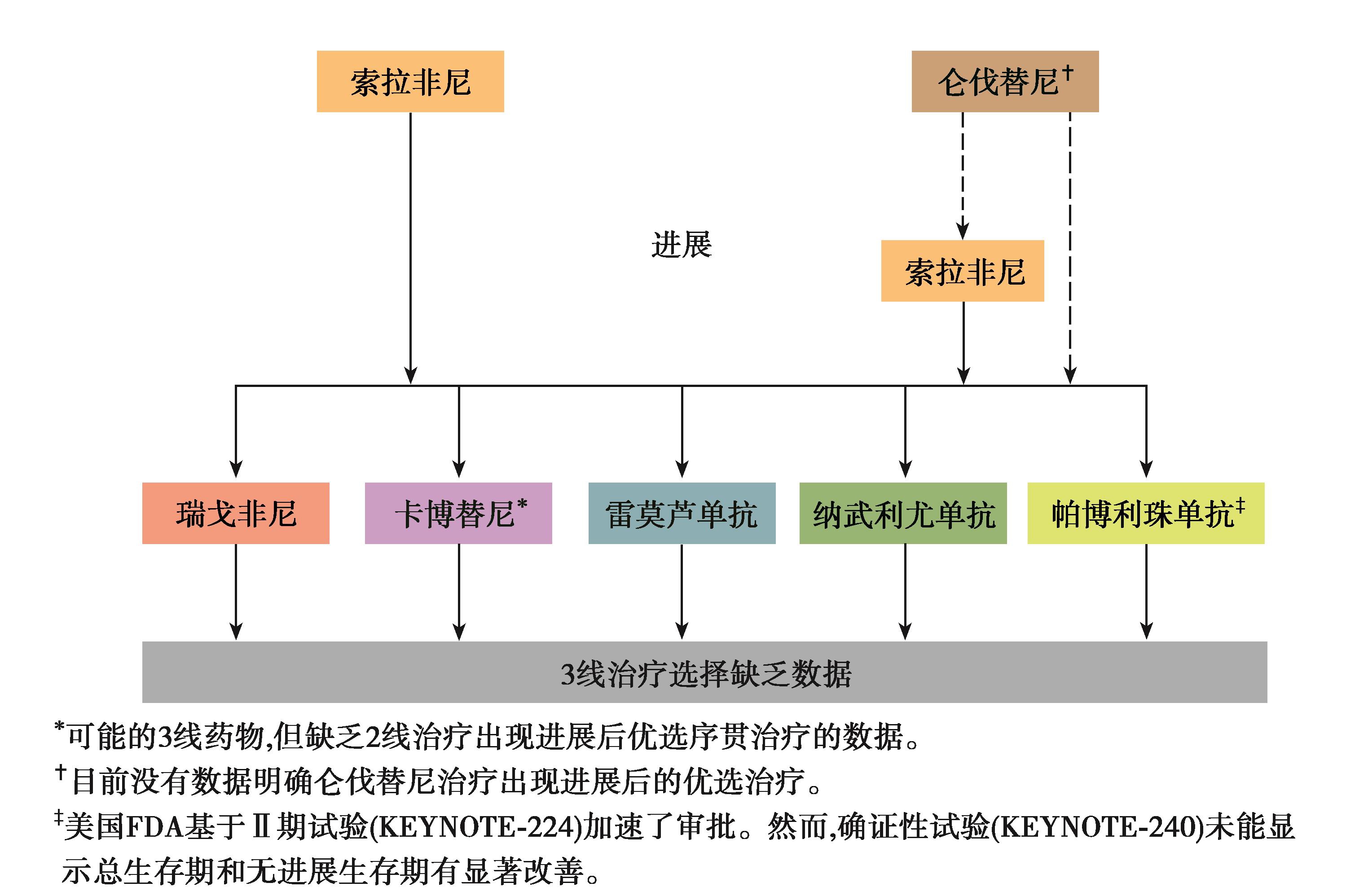
图2 晚期HCC一线分子靶向药物进展选择
2.卡博替尼
卡博替尼是一种以c-Met、VEGFR2和AXL为靶点的小分子TKI(图2)。CELESTIAL试验结果显示,该药物可显著改善病人的总生存期,已被美国FDA批准用于索拉非尼不可耐受/索拉非尼治疗中出现疾病进展的HCC病人。
3.雷莫芦单抗
雷莫芦单抗(ramucirumab)是一种抗VEGF单克隆IgG抗体。也是第一个被批准基于生物标志物选择的HCC病人群体的系统治疗药物,该药物对于甲胎蛋白(AFP)≥400ng/ml、索拉非尼不耐受/影像学进展的不可切除性HCC病人具有生存获益。其不良事件特征良好,剂量减少及停药的发生率低。美国FDA已批准雷莫芦单抗用于经索拉非尼治疗后且AFP≥400ng/ml的HCC病人。这也是美国FDA批准的首个生物标志物驱动的HCC疗法。AFP≥400ng/ml的病人的中位总生存期为7.8个月,对照组为4.2个月。相比之下,AFP<400ng/ml的病人中雷莫芦单抗组中位总生存期为10.1个月,而安慰剂组为11.8个月。
(三)分子靶向药物疗效个体化评估及预测
瑞戈非尼治疗组比安慰剂治疗组的AFP应答的比例更高(46% vs 11%);在瑞戈非尼治疗组,AFP应答与更长的OS相关(HR=0.72)。在瑞戈非尼治疗组,有/无AFP缓解的病人的影像学客观缓解率相似,但无AFP缓解的病人疾病进展比例更高。AFP缓解作为HCC治疗转归的潜在预测因子,仍需要进一步研究。
另外在分子靶向药物遗传药理学领域的探索,基因的多态性与分子靶向药物的疗效以及副作用密切相关,有待进一步深入研究及临床转化。
(四)HCC分子靶向药物发展前景
TGF-β抑制剂、TGF-β信号通路在HCC存在不同,甚至相反的作用机制。在肿瘤早期主要是抑制肿瘤细胞增殖。在晚期则促进肿瘤细胞的侵袭,血管生成、EMT转变和耐药。另外TGF-β信号通路通过T细胞排斥,降低免疫检查点抑制剂疗效。现已经开展Galunisertib(LY2157299,TGF-β受体1抑制剂)单药和联合索拉非尼在HCCⅠ~Ⅱ期的研究。
另外还有MET抑制剂tepotinib、capmatinib应用于HCC的探索性研究。FGFR4抑制剂BLU9931阻断FGF19/FGFR4信号通路,在FGF19高表达的HCC病人中进行Ⅰ期研究。相信随着基础与临床研究深入,未来HCC病人将有更多的分子靶向药物可供选择,如图2所示。
二、HCC免疫检查点抑制剂
免疫逃逸是肿瘤的基本特征,T淋巴细胞表面免疫检查点是其逃逸的主要途径,其中程序性死亡蛋白1(PD-1)和细胞毒T淋巴细胞相关抗原4(CTLA-4)是研究热点。肝脏是一种“免疫特惠”器官,来自肠道的多种抗原汇集于门静脉,必须经过肝脏代谢,为了避免过度免疫反应,肝脏中的免疫细胞不及其他组织器官活跃,加之慢性病毒性肝炎使得肝脏免疫系统处于耐受状态,这为HCC细胞发生免疫逃逸提供了天然的环境。
(一)HCC免疫检查点抑制剂二线治疗的进展
1.纳武利尤单抗
2017年9月美国FDA正式批准其二线治疗晚期HCC适应证。基于Ⅰ/Ⅱ期CheckMate-040试验中经过索拉非尼治疗的154例病人,按RECIST 1.1标准评价,客观缓解率(objective response rate,ORR)为14.3%,缓解持续时间(duration of response,DOR)为3.2~38.2个月,随访还在继续进行;mOS分别为15.6个月(扩展组)和15个月(剂量递增组)。
CheckMate-459为第一个发表的免疫检查点在晚期HCC一线治疗的Ⅲ期研究;研究未达到预设的具有统计学意义的OS主要终点,但是数据显示,纳武利尤单抗一线治疗晚期HCC具有改善OS的趋势,同时ORR和完全缓解率(complete response,CR)较高。纳武利尤单抗组mOS为16.4个月,而索拉非尼组mOS则为14.7个月(HR=0.85,95%CI:0.72~1.02,P=0.075 2)。PD-L1不同表达状态亚组及其他预先设定的亚组观察到的OS获益一致。接受纳武利尤单抗治疗病人的生活质量提高。
2.帕博利珠单抗
基于Ⅱ期临床试验KEYNOTE-224的研究结果,2018年11月帕博利珠单抗获得美国FDA批准用于索拉非尼治疗失败后的HCC病人。
随后,随机、对照三期临床研究KEYNOTE-240探究帕博利珠单抗和最佳支持治疗对接受过治疗的进展期HCC病人的疗效和安全性。结果显示,相比于安慰剂组,帕博利珠单抗组得到了3个月的OS延长获益(13.9个月 vs 10.6个月,HR=0.78,95%CI:0.611~0.998,P=0.0238);病人PFS方面也获得了改善(3个月 vs 2.8个月,HR=0.718,95%CI:0.570~0.904,P=0.0022),但可惜的是OS和PFS的差异无统计学意义(分别0.0174和0.002)。帕博利珠单抗组和安慰剂组的ORR分别为18.3%和4.4%(P=0.00007);帕博利珠单抗组的疗效持久,中位DOR为13.8个月(1.5~23.6个月);安全性较好,包括肝炎和其他免疫相关的副作用(immune-related adverse events,irAEs)的发生率,与先前报道的帕博利珠单抗研究基本一致。不同区域OS分析显示,亚洲病人的获益优于欧美病人。KEYNOTE-394是一项帕博利珠单抗联合BSC对比安慰剂联合BSC作为二线治疗,用于既往接受过系统治疗的亚洲晚期HCC受试者的随机、双盲Ⅲ期研究,期待后续的结果报道。
3.卡瑞利珠单抗
卡瑞利珠单抗已正式获得国家药品监督管理局(NMPA)批准,用于HCC领域的治疗,获批适应证为接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期HCC病人的治疗,为既往经过治疗的中国晚期HCC病人提供了一种新的安全有效的治疗选择,也是我国第一个在HCC领域获批的PD-1免疫治疗药。
卡瑞利珠单抗获批HCC二线适应证是基于其临床Ⅱ期研究的结果。纳入病人的基线情况较差。AFP≥400ng/ml的病人占51%,82%的病人有肝外转移,83%的病人为HBV感染者,23%的病人接受过两个或更多线既往系统性治疗。这更符合我国HCC病人的特征和国情。根据盲态独立中心评审(BICR)评估结果,ORR达到14.7%(95%CI:10.3~20.2),DCR为44.2%(95%CI:37.5~51.1),12个月的OS为55.9%(95%CI:48.9~62.2)。进一步亚组分析结果显示,158例索拉非尼经治人群中,ORR为17.1%(95%CI:11.6~23.9),6个月OS为75.8%(95%CI:68.3~81.7)。在安全性方面,病人对于卡瑞利珠单抗的耐受性良好,仅15%的病人因治疗相关不良事件(treatment-related adverse event,TRAE)需要暂停用药,仅4%的病人因TRAE停药。最常见的TRAE为反应性皮肤毛细血管增生症(reactive cutaneous capillary endothelial proliferation,RCCEP,67%),均为1或2级。结果分析RCCEP的发生与抗肿瘤疗效具有密切的相关性,因此,有可能成为与疗效相关的生物标记。
4.信迪利单抗
为重组全人源IgG4型PD-1单克隆抗体。临床前研究显示信迪利单抗与PD-1受体结合具有高亲和力和缓慢的解离速率,PD-1受体的高占位导致了更好的抗肿瘤免疫效应。临床药效学测试显示信迪利单抗在晚期实体瘤病人体内PD-1受体持续占位率平均高于95%,抗药抗体和中和抗体的低发生率和抗药抗体的低效价表明信迪利单抗的免疫原性风险低。信迪利单抗联合贝伐珠单抗生物类似药对比索拉非尼用于一线治疗晚期HCC的Ⅱ/Ⅲ期研究(ORIENT-32,CTR20182545)正在进行,目前已经完成入组。
5.替雷利珠单抗
是一款人源化IgG4型抗PD-1单克隆抗体药物,在HCC领域替雷利珠单抗注射液已经开展了多项临床研究,已有两项包含HCC的多瘤种研究公布了初步结果,初步证实了替雷利珠单抗注射液在晚期HCC中的有效性与安全性。
目前,帕博利珠单抗和纳武利尤单抗在国外获批HCC二线治疗适应证。相比较于HCC二线其他治疗选择如瑞戈非尼、卡博替尼、雷莫芦单抗等,帕博利珠单抗和纳武利尤单抗在临床研究中获得了更高的ORR(约20%),较长的OS,安全性良好。但KEYNOTE-240未达到预设的主要研究终点。这也提示为进一步提升免疫检查点抑制剂在HCC治疗中的价值,需要探索更为有效、安全的联合治疗模式。
(二)HCC免疫检查点抑制剂一线治疗的进展
CheckMate-459研究结果显示,与索拉非尼相比,纳武利尤单抗在主要终点总生存期并未达到统计学显著性(HR=0.85,95%CI:0.72~1.02,P=0.0752),即纳武利尤单抗对比索拉非尼未能显著改善病人的总生存期。由于HCC是一种高度异质性肿瘤,免疫微环境复杂,导致免疫检查点抑制剂单药治疗失败,联合免疫模式应当是未来的方向(表1)。
表1 HCC一线联合免疫方案汇总
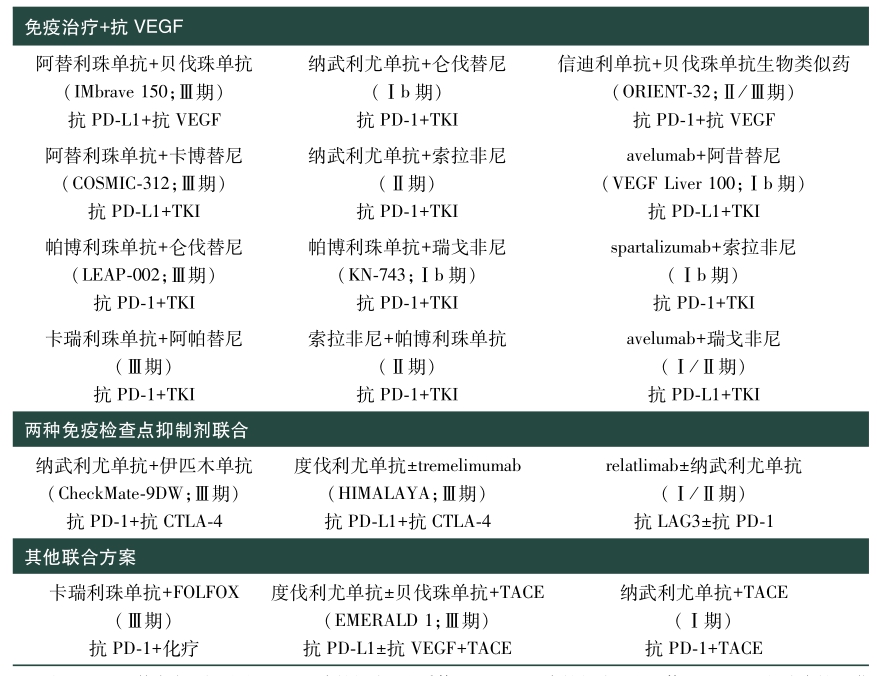
注:VEGF:血管内皮生长因子;PD-1:程序性细胞死亡受体-1;PD-L1:程序性细胞死亡配体-1;CTLA-4:细胞毒性T淋巴细胞相关蛋白4;TKI:酪氨酸激酶抑制剂;TACE:经导管肝动脉化疗栓塞术;LAG3:淋巴细胞活化基因3。
(三)免疫检查点抑制剂个体化疗效评估及预测
HCC的起源是体细胞基因组和表观遗传改变累积的结果。随着全外显子组测序(wholeexome sequencing,WES)及单核苷酸多态性(single-nucleotide polymorphism,SNP)等技术的广泛应用,HCC基因的全景图了解越发清晰。根据HCC主要的基因改变,国际上已将HCC分为增殖型和非增殖型两种分子亚型。其中增殖型的基因组特点是:基因特点与不良预后明显相关;TP53基因突变;染色体不稳定。临床特点:HBV感染;肿瘤细胞分化差;AFP高表达;预后差。非增殖型的基因组特点:CTNNB1突变;免疫排斥;基因表达与正常肝细胞类似。临床特点:HCV感染和酒精性肝硬化;肿瘤细胞分化良好;很少侵犯血管;预后良好。所以我们国家的HCC绝大部分归为增殖型。免疫类型为:免疫浸润M2细胞增加,免疫耗竭。根据HCC微环境免疫状态的免疫分类,分为免疫反应类、免疫过渡类和免疫排斥类(图3、图4)。不同的免疫状态类型与免疫检查点抑制剂疗效的相关性还有待进一步探索。
1.肿瘤微环境
在HCC中,间质细胞(库普弗细胞、树突状细胞、肝内皮细胞和肝星状细胞)和免疫抑制性细胞因子(例如IL-10或TGF-β)可能有助于免疫抑制环境,而PD-1/PD-L1通路在HCC免疫抑制微环境的发展中起着重要作用。HCC肿瘤微环境有极其复杂的细胞组成及相应差异蛋白表达。如PD-L1蛋白表达,肿瘤突变负荷(TMB),IFN-γ mRNA表达,微卫星不稳定性(MSI),肿瘤相关抗原特异性细胞毒性T淋巴细胞,肿瘤浸润淋巴细胞(TIL)等。

图3 依据HCC微环境免疫状态分类
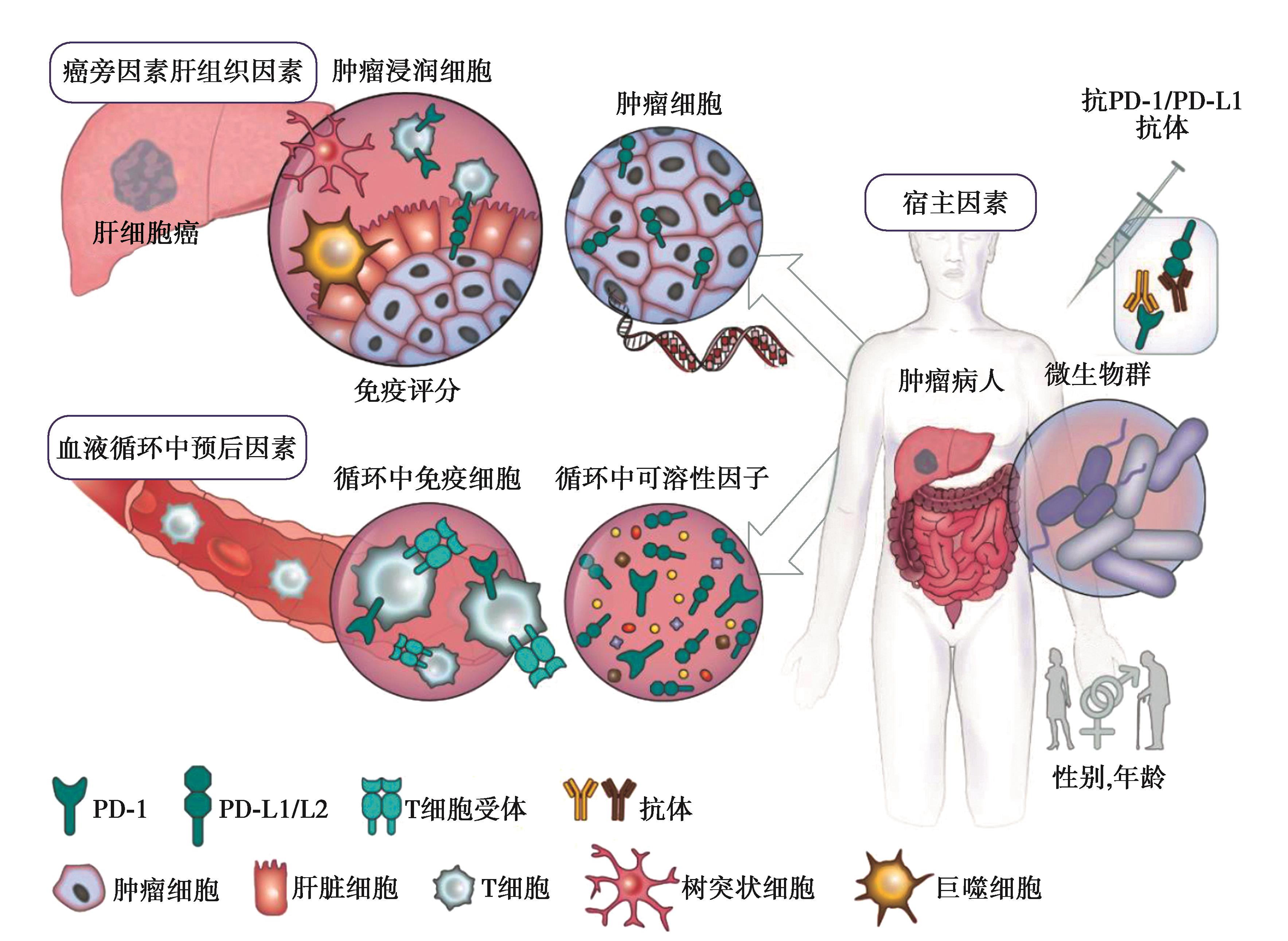
图4 HCCPD-1/PD-L1抑制剂疗效预测可能标志物概览
PD-1/PD-L1抑制剂疗效预测标志物探索和鉴定,在HCC免疫治疗个体化精准治疗中发挥重要作用。
对免疫检查点抑制剂(immune checkpoint inhibitors,ICI)疗效的研究最广泛的预测性生物标志物是肿瘤突变负荷(tumor mutation burden,TMB)和PD-L1表达。但TMB作为ICI治疗HCC疗效的预测指标的价值仍不明确,PD-L1表达作为连续变量是有用的预测性标志物,但并不能帮助决定哪些病人应接受抗PD-1治疗。在基于免疫的联合治疗时代,需要更全面的生物标志物研究方法来展示肿瘤微环境中免疫调节网络的复杂相互作用以及具有不同免疫调节作用的单个药物的疗效。
2.血清学/循环因子
为了减少对肿瘤活检病理的依赖,液态活检技术,分析CTCs或ct-DNA,ct-mRNA也是非常具有前景的疗效预测标志物。进一步深入了解信号通路与免疫状态的关系,如高表达PTK2信号通路与肿瘤内T淋巴细胞浸润减少密切相关。β-catenin(CTNNB1)信号通路的激活与T淋巴细胞排斥密切相关等也有助于PD-1/PD-L1抑制剂疗效预测标志物探索和临床转化。
3.假性进展
是免疫治疗中的一种应答情况,表现为先发生病灶的增大或新病灶的产生,可能被判断为PD,但随着免疫治疗的继续,靶病灶和新病灶可能会出现缩小,病人出现缓解。当淋巴细胞浸润肿瘤时,肿块可能表现为增大或者新病灶的出现。由于达到适应性免疫反应需要一定的时间,假性进展可能表现为肿瘤持续增长直至达到一定程度的缓解。
(四)免疫检查点抑制剂副作用(irAEs)研究进展
随着临床上免疫药物的广泛使用,我们对irAEs管理的理解仍在发展。肝硬化和Child-Pugh改良分级评分的影响值得在HCC中进行深入研究,因为早期临床试验的结果表明,与其他类型的肿瘤相比,使用基于ICI的药物组合治疗时,HCC病人的肝脏相关不良事件可能增加。回顾性观察发现发生irAE的病人具有更好的抗肿瘤作用,表明诱导抗肿瘤免疫和自身免疫反应之间存在共同的机制。阻断免疫检查点通路减少对免疫系统抑制作用,激活抗肿瘤的免疫反应,这种免疫活化作用会降低自身免疫耐受性,从而导致irAEs的发生。这类irAEs通常是低级别的副作用,但严重或危及生命的irAEs也有发生,会导致1%~2%的病人死亡。
irAEs的常见靶器官包括皮肤、胃肠道、肝、肺、内分泌器官,心脏、肾脏、神经、眼的irAEs相对少见。尽管irAEs的发生时间不同,大体在1~6个月内发生,但是大部分irAEs可逆。联合治疗(免疫、化疗、抗血管)毒性发生率高于单药治疗。长半衰期造成靶点的持续抑制和占据,可能导致免疫检查点抑制剂发生irAEs。开发半衰期短且保持理想抗瘤活性的免疫检查点抑制剂,是更好管理irAEs的有效策略。大多数irAEs可以通过暂停给药±类固醇皮质激素得以控制,且可以逆转。肝脏副作用发生率不高,但免疫治疗引起的肝炎通常为无症状性免疫相关性肝炎,表现谷丙转氨酶(ALT)、谷草转氨酶(AST)升高,合并或不合并胆红素升高,伴有发热。发生时间:出现转氨酶升高的中位时间为免疫治疗后6~14周。KEYNOTE-001研究发现,曾有胸部放射治疗史的病人使用帕博利珠单抗后,较无胸部放射治疗史者更易出现治疗相关的肺损伤(13% vs 1%)。其他潜在的危险因素可能有基础肺部疾病、吸烟等。5级肺炎:发生率为0.1%。免疫性心脏毒性发生率:6/10000,分析发生严重心肌炎的101例病人,其中46位死亡。发生时间:中位27天,76%在6周内出现,最短5天。RCCEP即反应性皮肤毛细血管增生症(reactive cutaneous capillary endothelial proliferation),常见于卡瑞利珠单抗单药治疗的病人,是一种免疫相关性副作用。RCCEP程度轻且具有自限性,任意级别发生率74.1%,3级以上发生率仅0.6%,在发生的RCCEP中1级占大部分(60.1%)副作用可控,不影响生命安全;RCCEP的中位发生时间为0.9个月,持续的中位时间4.6个月,用药6个月,部分病人可自行缓解和消退,并不留下明显瘢痕。卡瑞利珠单抗具有独特的PD-1结合表位,可能与引发独特的皮肤免疫反应有关。在抑制免疫逃逸的同时,可能激活了CD4+T细胞,释放IL-4,刺激具有促血管生成作用的M2型巨噬细胞的分化,最终导致血管内皮细胞的异常增生。卡瑞利珠单抗联合化疗或阿帕替尼治疗,可以明显降低RCCEP的发生率。
(五)HCC免疫治疗开发展望
随着该领域研究的不断深入,未来还有更多HCC免疫治疗靶点药物出现(图5)。
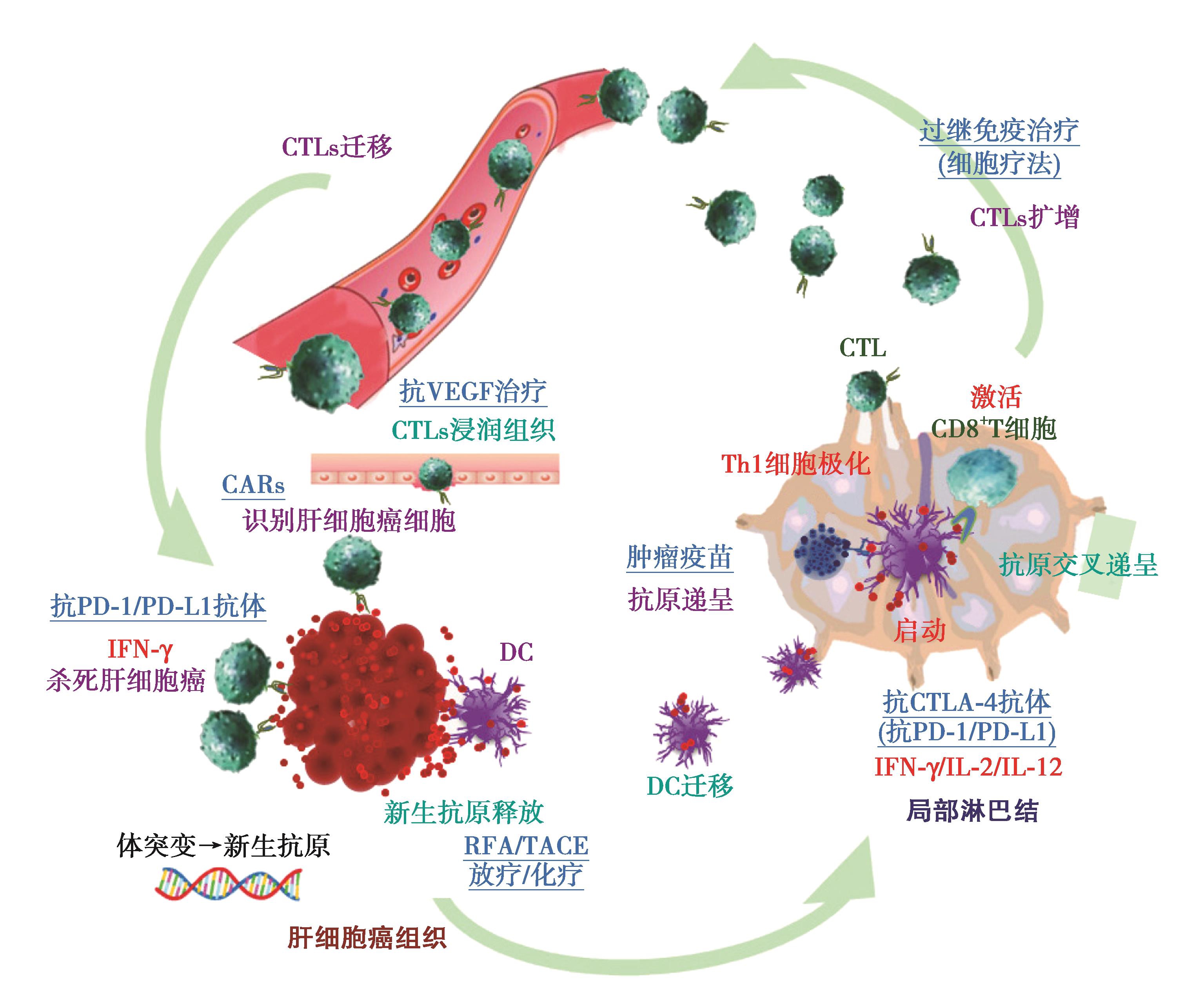
图5 肿瘤免疫循环及免疫治疗靶点
HCC细胞产生多种肿瘤相关抗原(tumor-associated antigens,TAA)。肿瘤免疫的起始环节是抗原递呈细胞,如树突样细胞(DCs),获取TAA和肿瘤抗原,DCs迁移至区域淋巴结,将处理的抗原递呈给CD4+T细胞,从而激活CD4+T增殖,诱导IFN-γ、IL-12和type I IFN,相关抗原因子在DCs的作用下促进抗原特异性CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTLs)的增殖活化。当CTLs聚集在HCC肿瘤组织内,这些抗原特异的CTLs通过分泌颗粒酶B穿孔素就会发挥抗肿瘤作用。局部治疗和系统化疗治疗通过肿瘤坏死可以起到暴露释放肿瘤抗原和TAA的作用。肿瘤疫苗可以促进抗原递呈。抗CTLA-4抗体主要在起始阶段促进Th1极化和激活CD8+T细胞。免疫细胞治疗(chimeric antigen receptor T-cell immunotherapy,CAR-T)可增加外周血抗肿瘤免疫细胞的数量。
HCC免疫治疗的病因学视角,根据不同病因导致的HCC采用不同的免疫治疗策略。不同病因HCC的局部微环境中免疫细胞的差异是采用不同免疫治疗的基础,尽管这个领域还存在许多的未知,需要进一步的探索(图6)。
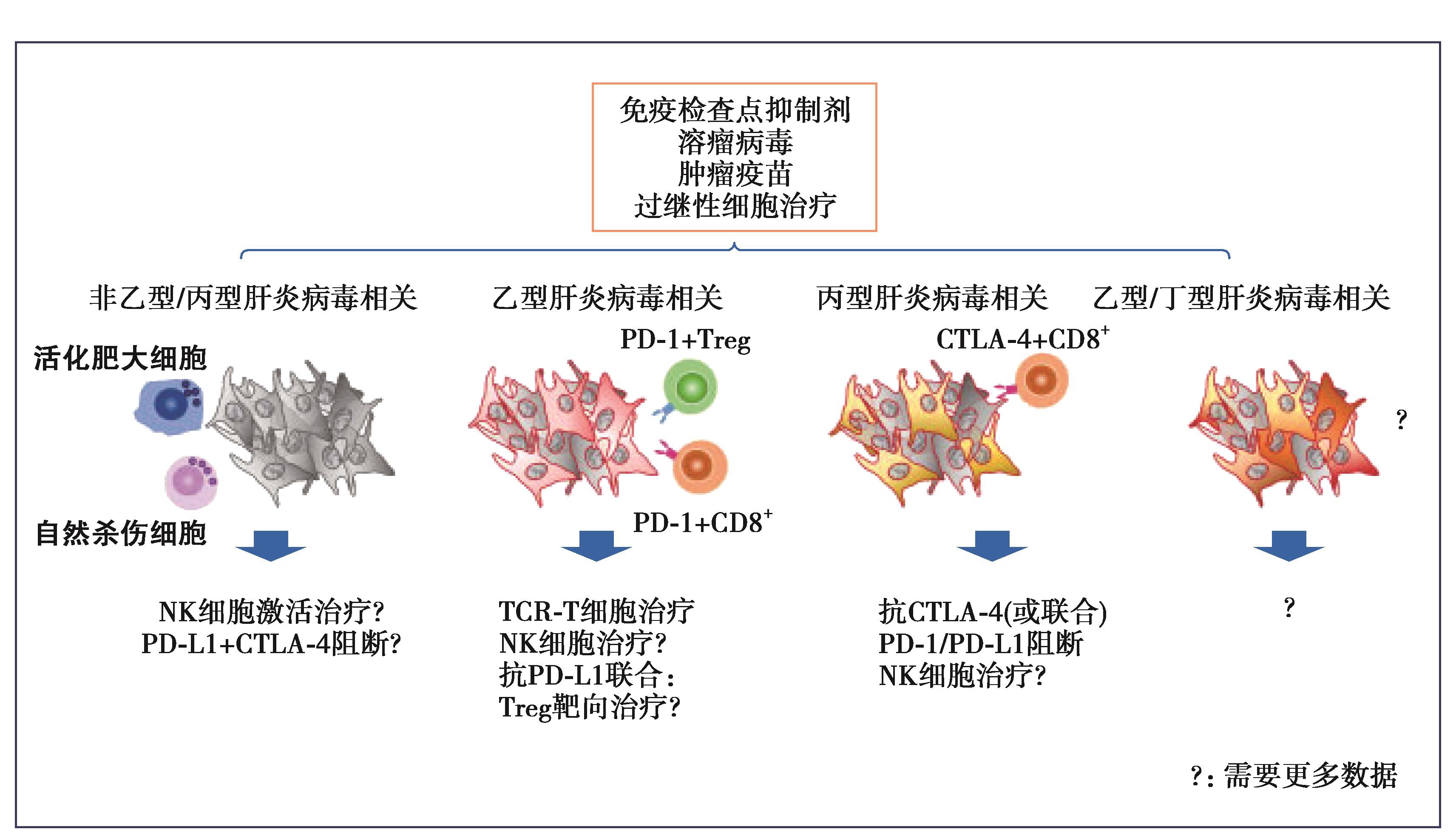
图6 未来HCC免疫治疗开发策略——病因学视角
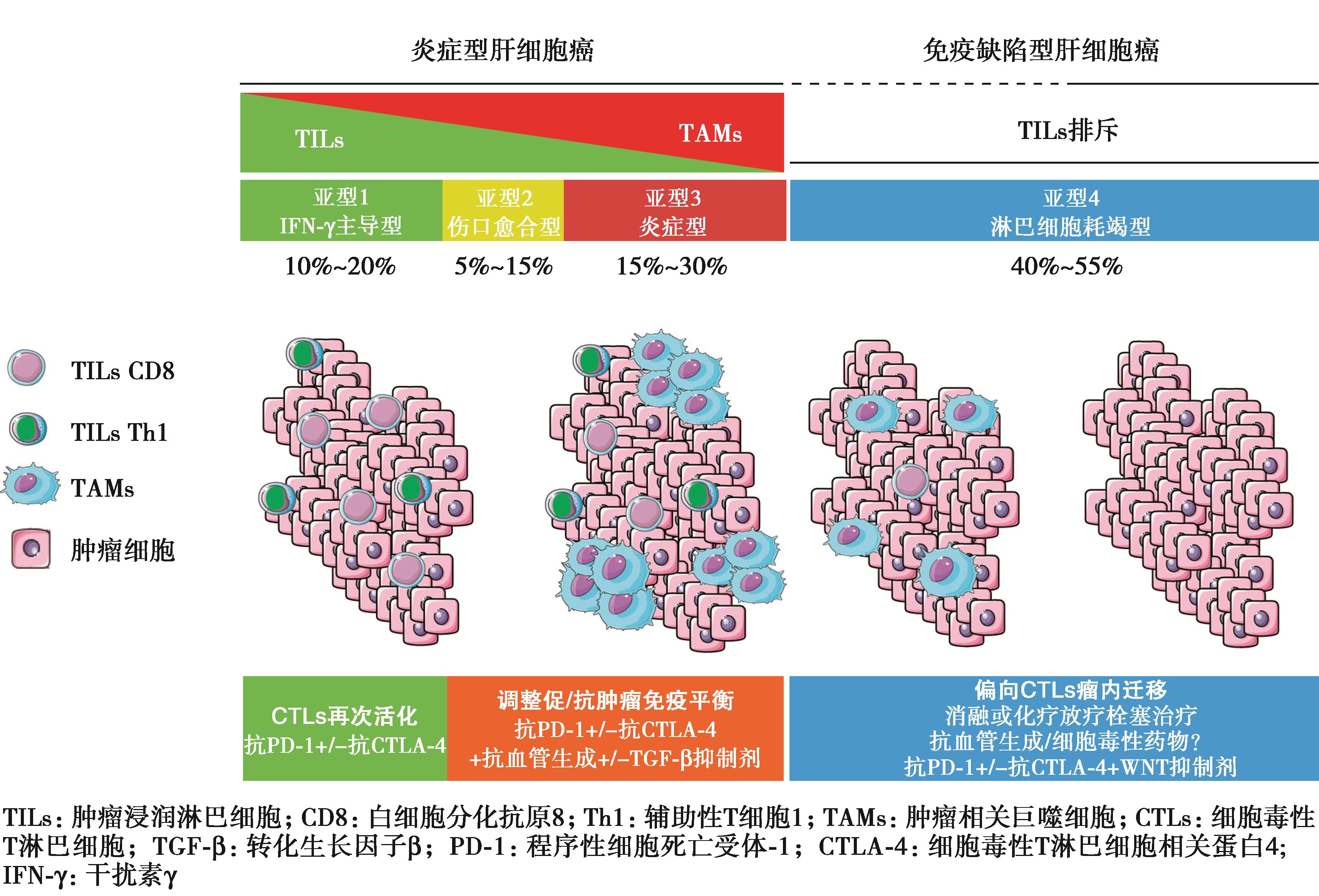
图7 未来HCC联合免疫开发策略——基于免疫学分型
根据HCC的病理免疫分型,探索免疫治疗的策略也是重要方向。最近的全肿瘤免疫基因组分析揭示了肿瘤内的6种免疫情况,它们与特定的免疫逃逸机制有关。作者分析了6种免疫模式在HCC样本中的分布如图所示(图7)。在HCC中,簇1和簇2并不常见。簇1与血管生成基因的表达升高有关,支持在这些病人中使用血管生成抑制剂。与其他亚型相比,簇3与更好的生存率显著相关。簇4是最常见的,没有明显的有害预后影响。在HCC中,簇5和簇6的代表性较弱。有趣的是,预测的新抗原数量与CD8+T细胞的数量呈正相关。高新抗原量在簇2和簇3中更为常见,与其他簇相比,CD8/Treg比值更高。
三、HCC免疫检查点抑制剂联合治疗进展及前景
HCC免疫检查点抑制剂联合治疗是目前研究的前沿领域,目前已存在多种联用方案,免疫与局部治疗的联合,如放射治疗、手术、介入;免疫与系统治疗的联合,如全身化疗、靶向抗血管治疗;以及与其他免疫检查点抑制剂的联合。其中免疫联合分子靶向治疗是热点(图8)。
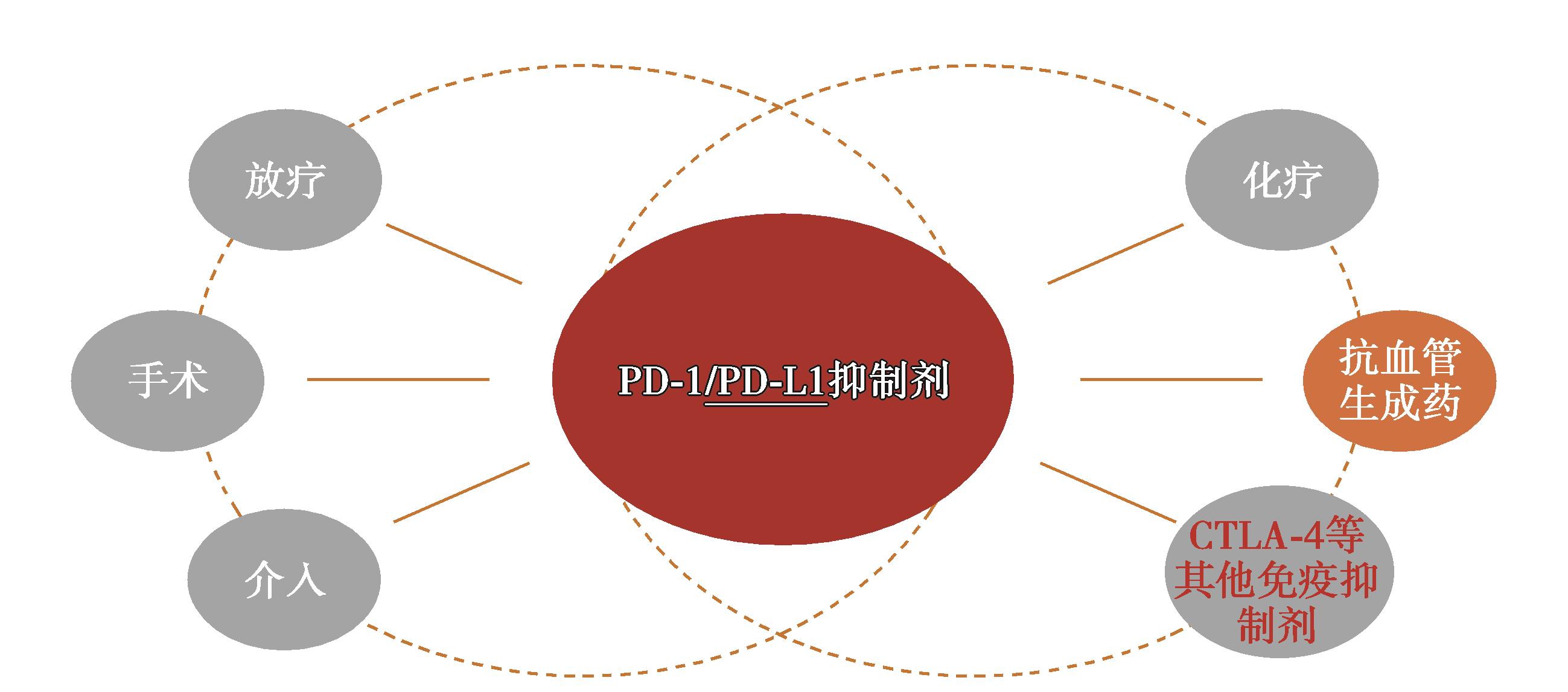
图8 HCC免疫检查点抑制剂联合治疗
(一)HCC分子靶向药物+免疫检查点抑制剂的应用进展及前景
毋庸置疑,目前该领域是联合治疗最具前景,也是正在进行临床研究最多的领域。近几年,每年开展的研究数量都在迅速增加,相信未来会有更多的联合应用组合进入HCC治疗一线、二线领域(图9)。
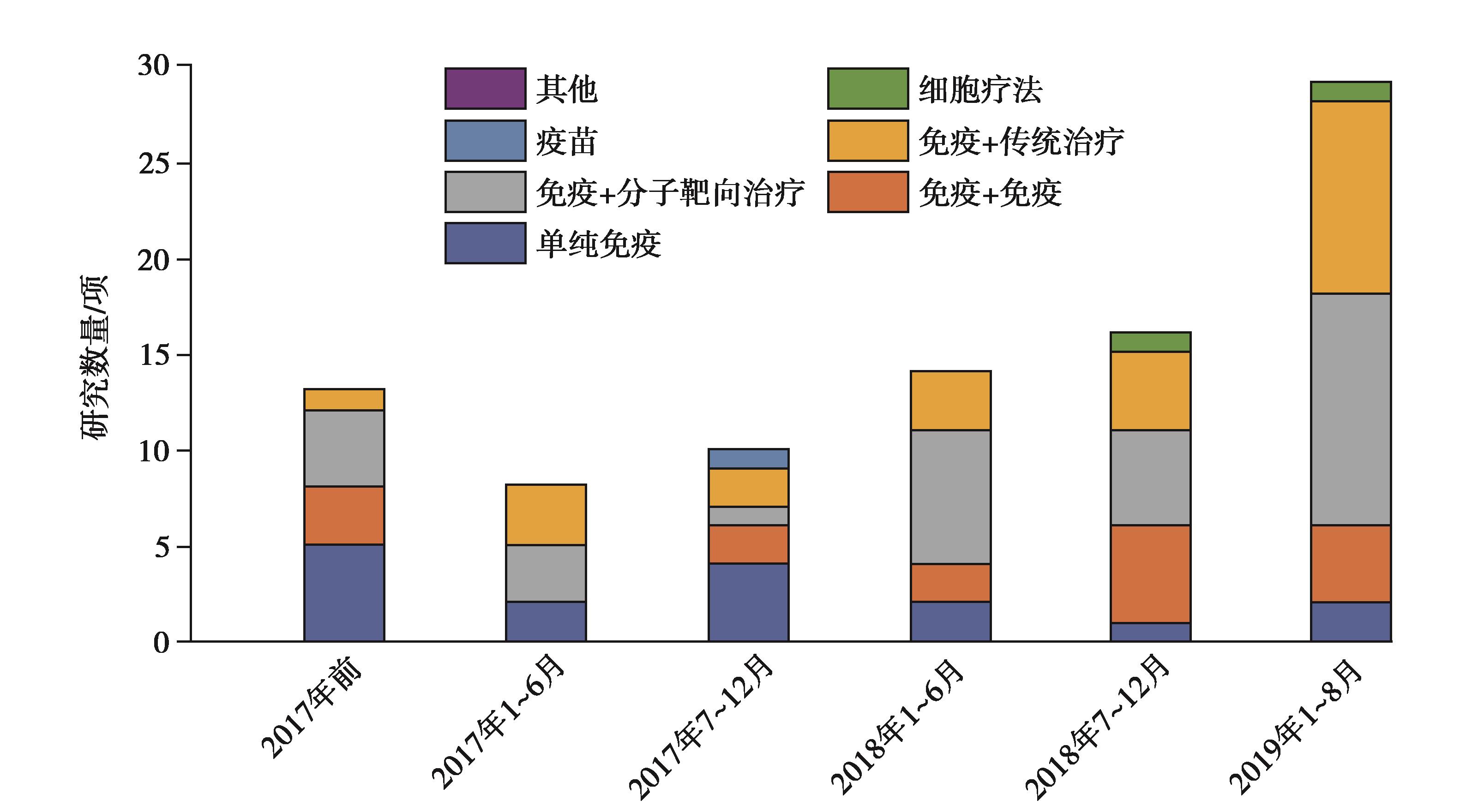
图9 HCC的免疫联合靶向临床研究数量
(二)HCC分子靶向药物+免疫检查点抑制剂联合应用的分子机制
Shigeta K等人使用HCC的原位移植模型或诱导鼠模型揭示了免疫靶向与分子靶向联合治疗的作用机制:在HCC中,双重PD-1和VEGFR-2阻断疗法,不仅可促进血管正常化,而且可增强抗肿瘤免疫应答。免疫与靶向联合的疗法重新编程了免疫微环境,通过增加CD8+细胞毒性T细胞浸润和活化,改变肿瘤相关巨噬细胞的M1/M2比例,减少HCC组织中的T调节细胞(Treg)和CCR2+单核细胞浸润来实现。在这些模型中,VEGFR-2在肿瘤内皮细胞中选择性表达。研究发现:内皮细胞中VEGFR-2被阻断时,HCC细胞以旁分泌方式诱导PD-L1表达,部分表达经干扰素γ表达诱导;VEGFR-2阻断还会增加肿瘤浸润CD4+细胞中的PD-1表达。
研究还发现,在抗VEGFR-2抗体的抗血管生成治疗中,加入抗PD-1治疗可使CD4+细胞发挥促进正常血管形成的作用。双重抑制PD-1和VEGFR-2通路,延长生存时间达1倍。肿瘤微环境的细胞通过释放VEGF,TGF-β和前列腺素E2(PGE2)等因子进入循环,发挥全身性的免疫抑制作用;细胞因子降低抗原递呈细胞引发T细胞的能力,从而降低效应T细胞的抗癌反应;增加骨髓来源抑制细胞(myeloid-derived suppressor cell,MDSC)和调节性T(Treg)细胞(图10~图13)。
![]()
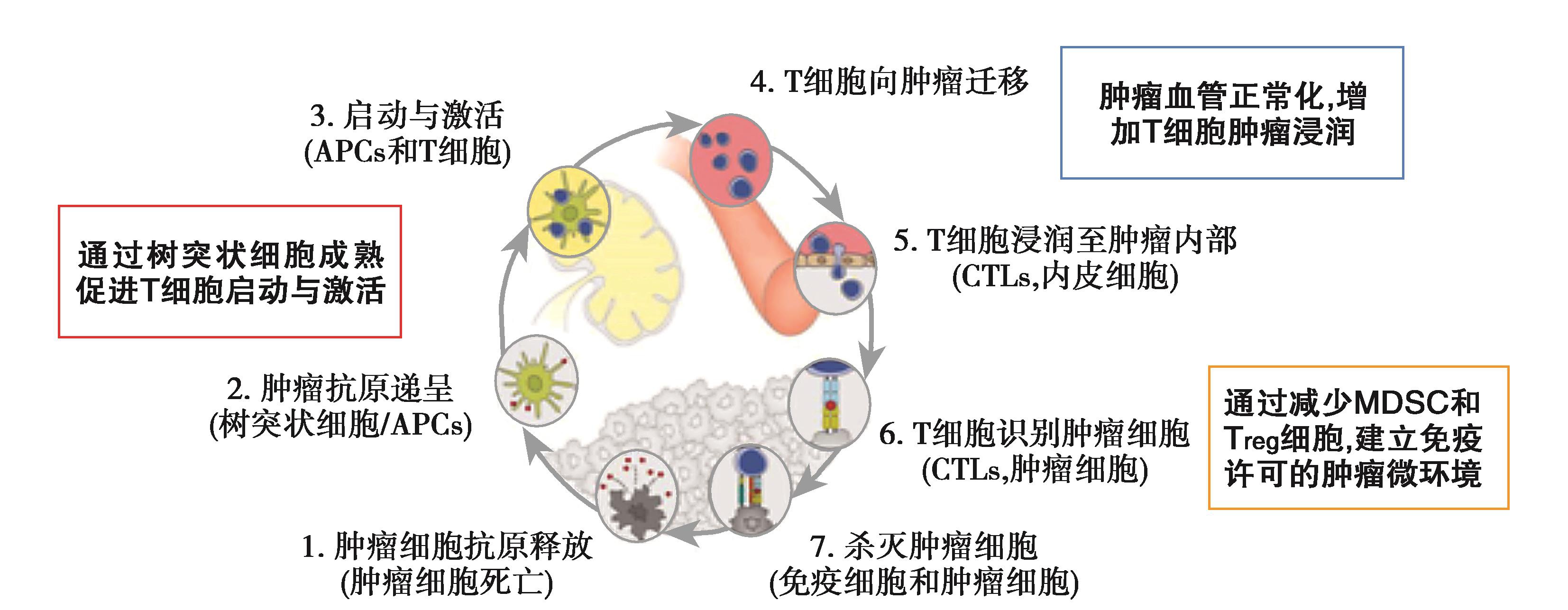
图10 抗血管生成药物对肿瘤免疫微环境的影响
![]()
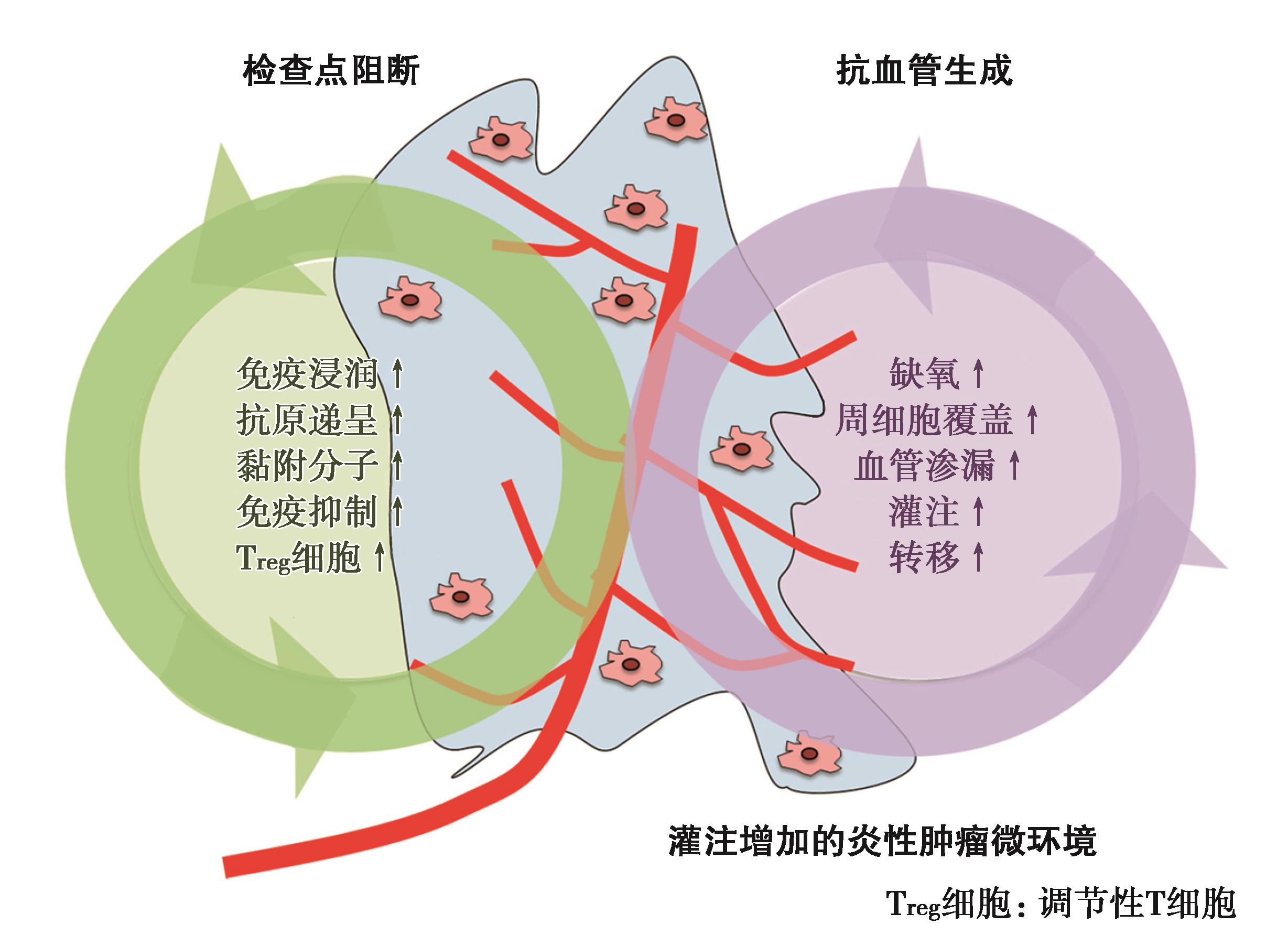
图11 免疫检查点抑制剂与抗血管生成联合肿瘤微环境重塑

图12 免疫检查点抑制剂与抗血管生成联合效应分子机制

图13 血管异常化介导免疫抑制的微环境 - 血管正常化免疫抑制环境转变为免疫支持环境
作为小分子细胞因子,VEGF释放可以引起肿瘤微环境的免疫抑制状态改变。VEGF-A可以引起MDSC的扩增、调节性T细胞的增殖与分化,并且抑制树突状前体细胞的成熟,最终导致NK细胞和T细胞的功能下降。更多研究表明,免疫调节作用与分子靶向抗血管生成的药物的剂量有关,低剂量更能发挥其局部诱导激活的效应。
(三)HCC分子靶向药物+免疫检查点抑制剂联合应用的模式探讨
不同的分子靶向抗血管生成药物作用机制不同,对免疫微环境的调节及分子机制也存在差别,如何采用合理的联合治疗模式仍有待进一步深入探讨(图14)。免疫检查点抑制剂在联合小分子TKI需要关注:
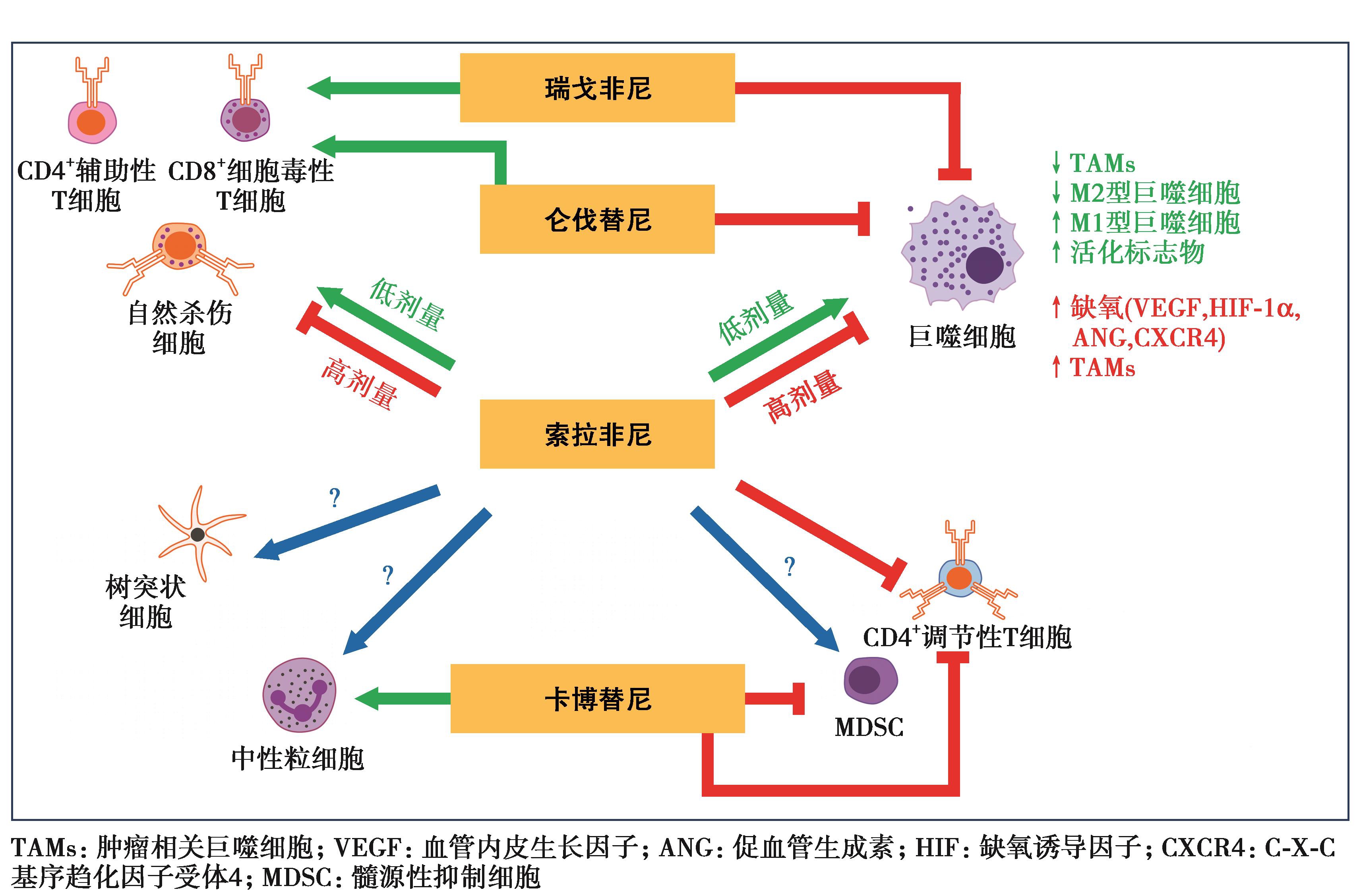
图14 不同分子靶向抗血管生成药物对免疫微环境分子调节机制
1.靶向抑制通路不同,对免疫细胞效应不同。
2.不同剂量对免疫细胞的效应不同,索拉非尼的作用可能是剂量依赖性的:较低的剂量更可能诱导血管正常化,减少缺氧并提高抗肿瘤免疫力(有益作用)。相比之下,更高的剂量可能反常地增强缺氧并促进免疫抑制(有害作用)。其他多激酶抑制剂(瑞戈非尼,仑伐替尼和卡博替尼)的剂量作用值得进一步研究。
3.免疫检查点抑制剂如何采用序贯、间断、持续的联合模式。
4.阐明TKI在免疫联合治疗中的作用,需要阐明TKI的抗VEGFR作用之外的免疫相关抗肿瘤机制,另外优化TKI的免疫有效剂量。
5.其他关键免疫介质的分离鉴定对于更全面使用合理的联合治疗模式至关重要。
(四)HCC分子靶向药物+免疫检查点抑制剂应用前景
在一些早期研究中,免疫治疗与抗血管生成治疗联合已经带来ORR的进一步提高。最近两年在此领域多项研究取得突破性结果,显示两者有机联合前景广阔。2018年7月阿替利珠单抗与贝伐珠单抗联合用药被美国FDA授予突破性疗法认定,用于晚期或转移性HCC的初始治疗。其主要依据来自GO30140Ⅰb期研究数据。研究比较了阿替利珠单抗联合贝伐珠单抗与阿替利珠单抗的疗效,证实联合疗法使得疾病恶化或死亡风险降低45%(HR=0.55,80%CI:0.40~0.74,P=0.010 8)。2019年11月发布的IMbrave150研究是一项全球随机多中心开放性Ⅲ期研究,在共同主要终点OS和PFS两方面都取得了阳性结果。结果证实阿替利珠单抗联合贝伐珠单抗与目前的标准治疗索拉非尼相比,显著改善了OS和PFS。研究中确认的ORR达到了27%。安全性方面,阿替利珠单抗+贝伐珠单抗联合给药安全性和耐受性良好。IMbrave150研究的中国人群分析显示:阿替利珠单抗联合贝伐珠单抗的mOS和mPFS均优于索拉非尼组,与主要研究结果一致。IMbrave150是第一个在HCC一线治疗中取得阳性结果,证实优于索拉非尼的Ⅲ期研究。在中国人群中,对比索拉非尼,阿替利珠单抗联合贝伐珠单抗治疗使得病人报告生活质量的恶化明显延迟,这些发现与全球人群中的发现一致。
2019年7月,美国FDA授予帕博利珠单抗与仑伐替尼组合疗法突破性疗法认定(breakthrough therapy designation,BTD),用于一线治疗晚期不可切除的HCC病人。获批基于开放标签、单臂、Ⅰb期仑伐替尼联合帕博利珠单抗治疗晚期HCC的临床试验KEYNOTE-524的研究结果。在ESMO会上新近更新的数据截至2019年6月30日,共囊括67例病人。两药联合后,独立影像评估中心根据mRECIST标准评估的ORR达到46.3%,而PFS达到9.7个月,mOS达到20个月。并且联合方案未出现不可预期的副作用,病人的严重副作用处于可控、可耐受的范围内。这项研究成为HCC治疗领域前所未有的突破性进展,展现了仑伐替尼联合帕博利珠单抗在HCC中优异的抗肿瘤疗效。仑伐替尼联合帕博利珠单抗对比仑伐替尼一线治疗晚期HCC病人的随机、双盲、多中心、Ⅲ期临床研究(LEAP-002)正在全球102个试验中心中开展,计划招募750名HCC病人。该试验旨在评价仑伐替尼联合帕博利珠单抗对比安慰剂联合仑伐替尼一线治疗晚期HCC病人的安全性和有效性。试验的主要研究终点为OS和PFS,次要研究终点为ORR、DOR、DCR、TTP以及安全性,预计于2022年试验结束,结果值得期待。仑伐替尼联合帕博利珠单抗以及TACE对比TACE的Ⅲ期、多中心、随机双盲对照试验LEAP-012同样正在开展。该试验计划入组950例晚期无转移灶的不可切除HCC病人,结果同样值得期待。
卡瑞利珠单抗(SHR-1210)联合阿帕替尼治疗晚期HCC、胃癌或胃食管结合部癌:一项开放标签的剂量递增和扩展研究在16例可评效的HCC病人中(4例125mg,11例250mg,1例500mg),ORR和DCR分别为50%(8/16)和93.8%(15/16),62.5%(10/16)的病人治疗期间靶病灶缩小。在250mg剂量组,ORR达53.8%(7/13)。卡瑞利珠单抗联合阿帕替尼对比索拉非尼一线治疗晚期HCC是国内首个PD-1抑制剂的随机、对照、开放、国际多中心Ⅲ期临床试验,试验对象随机分为两组,一组使用卡瑞利珠单抗200mg,Q2W+阿帕替尼,250mg/d,另一组使用索拉非尼400mg/d。研究的主要终点是OS和PFS。该研究已于2019年4月在上海正式启动,期待让更多HCC病人得到高质量生存获益的研究结果。
相信在该领域未来可能有更多临床研究结果将会发布,期待更多的“组合”给广大HCC病人带来更安全、更长的生存获益。
(五)HCC免疫检查点抑制剂+免疫检查点抑制剂联合应用前景
目前也是免疫检查点抑制剂联合应用的热点领域之一。其中双免疫检查点联合(PD-1+CTLA-4,CheckMate-040研究):纳武利尤单抗(Nivo)+伊匹木单抗(IPI)联合用于HCC二线治疗,美国FDA授予纳武利尤单抗与伊匹木单抗免疫组合疗法(简称“OY”组合)用于治疗既往已接受索拉非尼治疗的晚期HCC病人的突破性药物资格。此次补充生物制剂许可(sBLA)基于Ⅰ/Ⅱ期CheckMate-040(NCT01658878)研究的OY队列结果。这是一项正在进行的开放标签、多队列研究,在先前未接受过索拉非尼治疗(索拉非尼初治)、对索拉非尼不耐受或在接受索拉非尼治疗期间病情进展、存在或不存在病毒性肝炎的晚期HCC病人中开展,探讨NIVO或基于NIVO的组合疗法的疗效和安全性。
NIVO+IPI联合治疗既往接受过索拉非尼治疗的HCC病人可带来强力且持久的缓解,联合治疗的ORR(各组ORR>30%)均高于NIVO单药治疗(14%),无论基线PD-L1状态如何均有缓解。CheckMate-040研究中NIVO+IPI治疗带来的持久肿瘤缓解和可控的安全性表明NIVO+IPI或许可作为接受过索拉非尼治疗的进展期HCC的一种新的治疗选择。基于NIVO+IPI良好的疗效与安全性,该联合治疗模式可在HCC病人中作进一步的探索。
四、HCC局部+系统治疗模式及展望
虽然外科依然是HCC的首选治疗方法,由于大多数HCC病人存在基础肝病,HCC起病隐匿,在早期没有显示出典型的症状或体征,在确诊时大多数已达中晚期,能获得手术的机会为20%~30%。
HCC降期转化治疗:
即通过局部或者联合系统治疗等手段降低分期,将不可切除手术的中晚期HCC病人转化为可手术切除的早中期HCC,或者通过相关治疗手段将姑息性切除转变为根治性切除。大量研究表明,降期成功标准为米兰标准,移植成功率为55%~78%。并且超米兰标准成功降期至米兰标准内行肝移植的病人与在米兰标准内行肝移植的病人,在移植后5年生存及复发情况相当。有研究表明HCC病人,局部治疗后行二期切除1年生存率为77.0%~91.4%,3年生存率为55.0%~77.1%,5年生存率为52.0%~69.6%。
随着介入技术、放射治疗技术的快速发展,目前常用的降期手段如cTACE、DEB-TACE、HAIC、RFA、TARE、内放射治疗、外放射治疗等局部治疗的手段或联合应用等,通过减轻肿瘤负荷、降低分期,使超出肝移植或肝切除标准的病人重新获得肝移植或手术切除的机会。
已有较多研究表明,局部治疗导致的肿瘤坏死有利于增强联合肿瘤免疫治疗效果。释放肿瘤抗原并引发与损害相关的分子诱导免疫原性细胞死亡,从而促进抗肿瘤免疫。TACE诱导的肝肿瘤细胞坏死增强了AFP特异CD4+T细胞的应答。一项纳入21例HCC病人的临床研究显示:TACE后,AFP-特异CD4+T细胞含量增加且对TACE有临床应答的病人,AFP特异CD4+T细胞含量都较高。研究表明TACE可明显提升肿瘤相关抗原(tumor-associated antigen,TAA)特异的CD8+T细胞的反应,TACE与CPI的联合具有合理性:①减少肿瘤负荷;②CPI将在高免疫原性的肿瘤微环境中发挥作用,增强肿瘤免疫治疗效果;③联合应用表明具有激活抗肿瘤免疫效应。RFA增强HCC相关抗原特异性T细胞应答。有研究结果显示62.3%的病人检测到肿瘤相关抗原特异性T细胞增加,RFA后观察T细胞表型的改变。近距离放射治疗联合免疫治疗减少MDSC细胞的局部聚集,改变免疫抑制微环境。
纳武利尤单抗单药与纳武利尤单抗+伊匹木单抗治疗可切除HCC病人的随机,开放标签的围手术期的Ⅱ期研究未发生新的有关免疫相关不良事件,6例病人出现了≤3级毒性反应(联合治疗约为27%)手术切除安全,无延迟或并发症,病理完全缓解(pCR)达到25%。
局部治疗前开始免疫治疗的研究探索,Tremelimumab是一种CTLA-4抗体,这是一个介入联合免疫的可行性研究。于用药后第36周进行介入治疗。主要终点是联合治疗的可行性。总TTP中值为7.4个月;6个月PFS 57.1%,12个月PFS 33.1%;mOS 12.3个月;安全性良好,无剂量限制性毒性。纳武利尤单抗+DEB-TACE治疗中期HCC的Ⅱ期临床研究-NCT03143270研究设计,2017年5月启动,仍在入组招募中,有待结果进一步的公布。
可切除HCC联合免疫治疗预防术后复发的研究也在进行中,该研究是一项围手术期免疫联合手术切除的Ⅱ期随机对照研究(NCT03222076),纳武利尤单抗联合伊匹木单抗术前用于可切除HCC,入组9例病人已有3例获得pCR,病理证实与肿瘤局部CD8+T细胞浸润显著相关。与分子靶向治疗相比,免疫治疗联合其他治疗方式不仅显著延长病人的总生存期,远期生存率也获益。帕博利珠单抗在早期HCC中的试验也有开展。例如,KEYNOTE-937试验,是一项Ⅲ期、双盲、平行对照试验,旨在评估HCC病人术后或射频消融后帕博利珠单抗辅助治疗的安全性和有效性,病人最长接受1年术后辅助治疗。该试验计划入组950例病人,目前正在病人入组当中(图15)。

图15 早中晚期HCC联合免疫治疗三期临床研究汇总
五、小结
随着分子靶向及免疫检查点抑制剂药物的快速发展,HCC局部加系统治疗模式已逐步进入临床实践。深入进行HCC的多组学研究,确立HCC的不同分子分型、免疫表型,以实现个体化的精准诊断和治疗。Bio-marker驱动的联合治疗临床研究,包括PD-L1、TMB、MSI和TIL等,积极探索疗效及安全性分子标志物,指导临床研究,从而制定个体化的整体治疗方案。创新优化以精准外科为核心的综合治疗新模式,快速提升我国HCC整体5年生存率,将从梦想转变成现实(图16)。
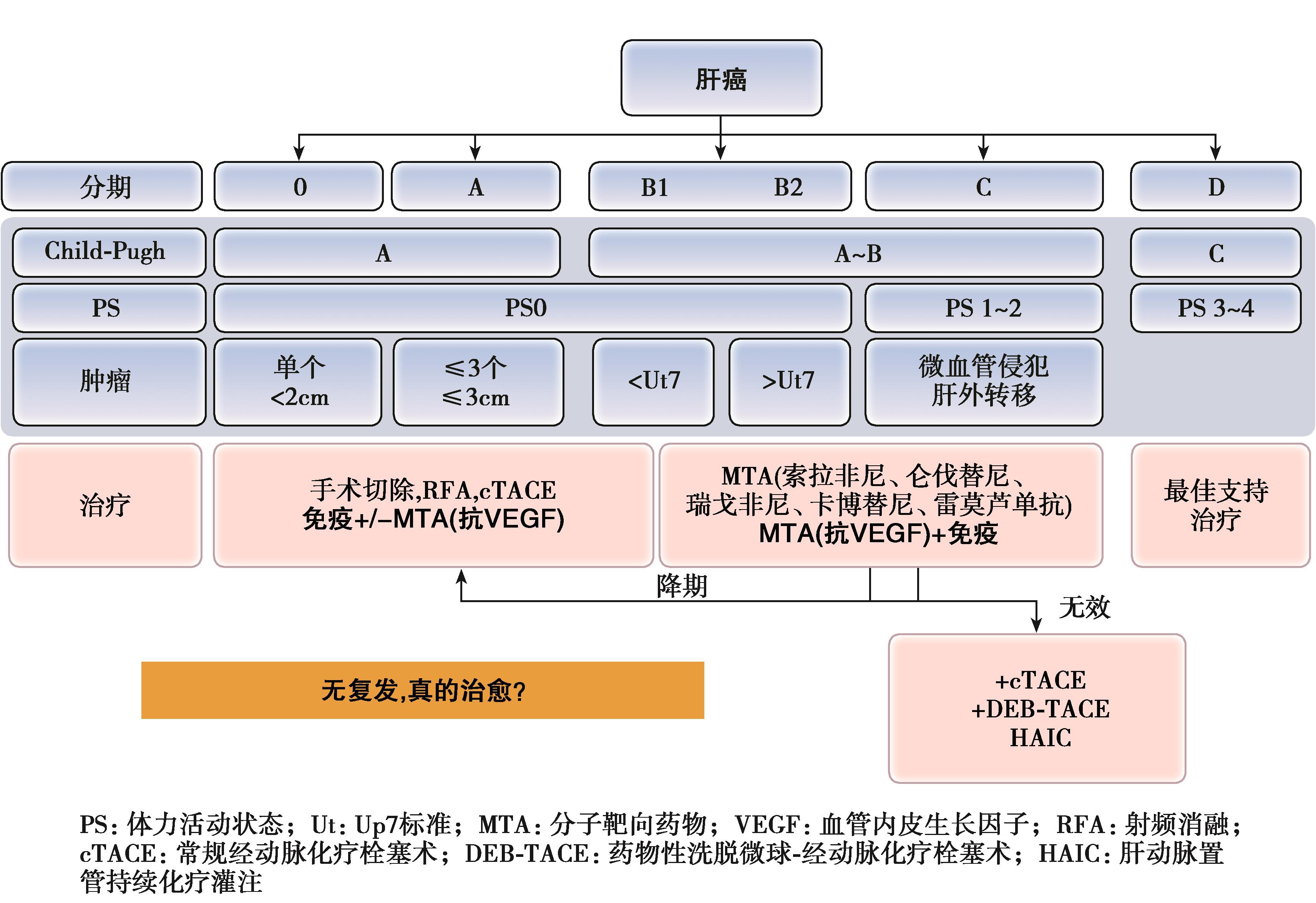
图16 HCC治疗未来蓝图
1960年3月生,江苏淮安人。中国工程院院士,医学博士,教授,主任医师。现任清华大学临床医学院院长,北京清华长庚医院院长,清华大学精准医学研究院院长。中国医师协会常务副会长,法国国家外科学院荣誉院士、美国外科协会和欧洲外科协会荣誉会士。董家鸿教授是国际著名肝胆外科专家和肝脏移植专家,在国际上首次提出“精准外科”新理念,创立了精准肝胆外科范式。这一理念已被广泛应用于诸多临床专科领域,促进了当代外科理念和范式的革新。以第一作者或通讯作者发表SCI论文60余篇,主持制定15部行业指南。主编出版专著6部。主持国家科技支撑计划等项目20余项;作为第一完成人获得国家科学技术进步奖二等奖1项和省部级一等奖3项,作为合作完成人获得国家科学技术进步奖一等奖1项。
副主任医师。中华放射学会介入专委会青年委员,中国抗癌协会肿瘤介入学专业委员会青年委员,中国抗癌协会肿瘤微创专业委员会青年委员。擅长肝胆胰疾病介入诊疗,特别在门静脉高压症的综合治疗,PVE在肝脏外科的应用,不可切除肝癌的精准介入治疗,布加氏综合征的介入治疗,胆道梗阻的综合介入治疗方面等方面有较深入的研究和探索。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]NAULT J C,CHENG A L,SANGRO B,et al.Milestones in the pathogenesis and management of primary liver cancer[J].J Hepatol,2020,72(2):209-214.
[2]CHENG A L,KANG Y K,LIN D Y,et al.Sunitinib versus sorafenib in advanced hepatocellular cancer:results of a randomized phase Ⅲ trial[J].J Clin Oncol,2013,31(32):4067-4075.
[3]JOHNSON P J,QIN S,PARK J W,et al.Brivanib versus sorafenib as first-line therapy in patients with unresectable,advanced hepatocellular carcinoma:results from the randomized phase Ⅲ BRISK-FL study[J].J Clin Oncol,2013,31(28):3517-3524.
[4]CAINAP C,QIN S,HUANG W T,et al.Linifanib versus Sorafenib in patients with advanced hepatocellular carcinoma:results of a randomized phase Ⅲ trial[J].J Clin Oncol,2015,33(2):172-179.
[5]ZHU A X,ROSMORDUC O,EVANS T R,et al.SEARCH:a phase Ⅲ,randomized,double-blind,placebo-controlled trial of sorafenib plus erlotinib in patients with advanced hepatocellular carcinoma[J].J Clin Oncol,2015,33(6):559-566.
[6]ABOU-ALFA G K,SHI Q,KNOX J J,et al.Assessment of treatment with sorafenib plus doxorubicin vs sorafenib alone in patients with advanced hepatocellular carcinoma:phase 3 calgb 80802 randomized clinical trial[J].JAMA Oncol,2019,5(11):1582-1588.
[7]KUDO M.Proposal of primary endpoints for tace combination trials with systemic therapy:lessons learned from 5 negative trials and the positive tactics trial[J].Liver Cancer,2018,7(3):225-234.
[8]KUDO M,FINN R S,QIN S,et al.Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma:a randomised phase 3 non-inferiority trial[J].Lancet,2018,391 (10126):1163-1173.
[9]DUFFY A G,ULAHANNAN S V,MAKOROVARUSHER O,et al.Tremelimumab in combination with ablation in patients with advanced hepatocellular carcinoma[J].J Hepatol,2017,66(3):545-551.
[10]KUDO M.Immuno-Oncology Therapy for Hepatocellular Carcinoma:Current Status and Ongoing Trials[J].Liver Cancer,2019,8(4):221-238.
[11]TADA T,KUMADA T,HIRAOKA A,et al.Safety and efficacy of lenvatinib in elderly patients with unresectable hepatocellular carcinoma:A multicenter analysis with propensity score matching[J].Hepatol Res,2020,50(1):75-83.
[12]HIRAOKA A,KUMADA T,KARIYAMA K,et al.Clinical features of lenvatinib for unresectable hepatocellular carcinoma in real-world conditions:Multicenter analysis[J].Cancer Med,2019,8(1):137-146.
[13]TSUCHIYA K,KUROSAKI M,KANEKO S,et al.A nationwide multicenter study in patients with unresectable hepatocellular carcinoma treated with lenvatinib in real world practice in Japan[J].J Clin Oncol,2019,37(4_suppl):364-364.
[14]CHEN S,CHAO Y,CHEN M,et al.Lenvatinib for the treatment of HCC:A single institute experience[J].J Clin Oncol,2019,37(suppl):e15611.
[15]KUDO M,UESHIMA K,CHAN S,et al.Lenvatinib as an initial treatment in patients with intermediate-stage hepatocellular carcinoma beyond up-to-seven criteria and Child-pugh a liver function:a proof-of-concept study[J].Cancers(Basel),2019,11(8):1084.
[16]ZHU A X,KANG Y K,YEN C J,et al.Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased alpha-fetoprotein concentrations(REACH-2):a randomised,double-blind,placebo-controlled,phase 3 trial[J].Lancet Oncol,2019,20(2):282-296.
[17]JOSEP M L,CHIA-JUI Y,RICHARD S F,et al.Ramucirumab(RAM)for sorafenib intolerant patients with hepatocellular carcinoma(HCC)and elevated baseline alpha fetoprotein(AFP):Outcomes from two randomized phase 3 studies(REACH,REACH2)[J].J Clin Oncol,37,15:4073.
[18]QIU L,QIN S K,SHANZHI G,et al.Apatinib in Chinese patients with advanced hepatocellular carcinoma:A phase Ⅱ randomized,open-label trial[J].J Clin Oncol,2014,32(15_suppl):4019-4019.
[19]SUN H C,ZHU X D,ZHOU J,et al.Effect of postoperative apatinib treatment after resection of hepatocellular carcinoma with portal vein invasion:a phase Ⅱ study[J].J Clin Oncol,2020,38:514.
[20]BRUIX J,REIG M,MERLE P,et al.Alpha-fetoprotein(AFP)response in patients with unresectable hepatocellular carcinoma(HCC)in the phase 3 RESORCE trial[J].Ann Oncol,2019,30(suppl_5):v253-v324.
[21]DE MATTIA E,CECCHIN E,GUARDASCIONE M,et al.Pharmacogenetics of the systemic treatment in advanced hepatocellular carcinoma[J].World J Gastroenterol,2019,25(29):3870-3896.
[22]FAIVRE S,RIMASSA L,FINN R S.Molecular therapies for HCC:Looking outside the box[J].Hepatol,2020,72(2):342-352.
[23]LI D,SEDANO S,ALLEN R,et al.Current treatment landscape for advanced hepatocellular carcinoma:patient outcomes and the impact on quality of life[J].Cancers,2019,11(6):841.
[24]YAU T,PARK J W,FINN R S,et al.CheckMate 459:A randomized,multi-center phase 3 study of nivolumab(nivo)vs sorafenib(sor)as first-line(1l)treatment in patients(pts)with advanced hepatocellular carcinoma(aHCC)[J].Ann Oncol,2019,30(suppl_5):v851-v934.
[25]FINN R S,RYOO B Y,MERLE P,et al.Pembrolizumab as second-line therapy in patients with advanced hepatocellular carcinoma in keynote-240:a randomized,double-blind,phase iii trial[J].J Clin Oncol,2020,38(3):193-202.
[26]DENG L,LIANG H,BURNETTE B,et al.Irradiation and anti-PD-L1 treatment synergistically promote antitumor immunity in mice[J].J Clin Invest,2014,124(2):687-695.
[27]KUDO M,LIM H Y,CHENG A L,et al.Phase Ⅲ study of pembrolizumab(pembro)versus best supportive care(BSC)for second-line therapy in advanced hepatocellular carcinoma(aHCC):KEYNOTE-240 Asian subgroup[J].J Clin Oncol,2020,38(4_suppl):526-526.
[28]QIN S,REN Z,MENG Z,et al.Camrelizumab in patients with previously treated advanced hepatocellular carcinoma:a multicentre,open-label,parallel-group,randomised,phase 2 trial[J].Lancet Oncol,2020,21 (4):571-580.
[29]WANG J,FEI K,JING H,et al.Durable blockade of PD-1 signaling links preclinical efficacy of sintilimab to its clinical benefit[J].MABS,2019,11(8):1443-1451.
[30]ANDREW X,RICHARD S,JULIEN E,et al.Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib(KEYNOTE-224):a non-randomised,open-label phase 2 trial[J].Lancet Oncol,2018,19(7):940-952.
[31]TODD S.Nivolumab(nivo)in sorafenib(sor)-naive and-experienced pts with advanced hepatocellular carcinoma(HCC):Check Mate 040 study[J].J Clin Oncol,32017,5(15_suppl):4013.
[32]VILLANUEVA A.Hepatocellular Carcinoma[J].N Engl J Med,2019,380(15):1450-1462.
[33]SIA D,JIAO Y,MARTINEZ-QUETGLAS I,et al.Identification of an immune-specific class of hepatocellular carcinoma,based on molecular features[J].Gastroenterology,2017,153(3):812-826.
[34]JILKOVA Z M,ASPORD C,DECAENS T.Aspord and t.decaens,predictive factors for response to pd-1/pd-11 checkpoint inhibition in the field of hepatocellular carcinoma:current status and challenges[J].Cancers,2019,11(10):1554.
[35]NISHINO M,RAMAIYA N H,HATABU H,et al.Monitoring immune-checkpoint blockade:response evaluation and biomarker development[J].Nat Rev Clin Oncol,2017,14(11):655-668.
[36]LLOVET J M,MONTAL R,SIA D,et al.Molecular therapies and precision medicine for hepatocellular carcinoma[J].Nat Rev Clin Oncol,2018,15(10):599-616.
[37]WANG Q,GAO J,WU X.Pseudoprogression and hyperprogression after checkpoint blockade[J].Int Immunopharmacol,2018,58:125-135.
[38]WEINMANN H.Cancer immunotherapy:selected targets and small-molecule modulators[J].Chem Med Chem,2016,11(5):450-466.
[39]SASIKUMAR P,SHRIMALI R,ADURTHI S,et al.A novel peptide therapeutic targeting PD1 immune checkpoint with equipotent antagonism of both ligands and a potential for better management of immune-related adverse events[J].J Immunother Cancer,2013,1(Suppl 1):24.
[40]SHAVERDIAN N,LISBERG A E,BORNAZYAN K,et al.Previous radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung cancer:a secondary analysis of the KEYNOTE-001 phase 1 trial[J].Lancet Oncol,2017,18(7):895-903.
[41]MOSLEHI J J,SALEM J E,SOSMAN J A,et al.Increased reporting of fatal immune checkpoint inhibitor-associated myocarditis[J].The Lancet,2018,391(10124):933.
[42]JOO-HO L,SOO Y O,JIN Y K,et al.Cancer immunotherapy for hepatocellular carcinoma[J].Hepatoma Res,2018,4:51.
[43]MIZUKOSHI E,YAMASHITA T,ARAI K,et al.Enhancement of tumor-associatedantigen-specific T cell responses by radiofrequency ablation of hepatocellular carcinoma[J].Hepatology,2013,57(4):1448-1457.
[44]HILMI M,NEUZILLET C,CALDERARO J,et al.Angiogenesis and immune checkpoint inhibitors as therapies for hepatocellular carcinoma:current knowledge and future research directions[J].J Immunother Cancer,2019,7(1):1-13.
[45]CHENG A,HSU C,CHAN S L,et al.Challenges of combination therapy with immune checkpoint inhibitors for hepatocellular carcinoma[J].J Hepatol,2020,72(2):307-319.
[46]SHIGETA K,DATTA M,HATO T,et al.Dual programmed death receptor-1 and vascular endothelial growth factor receptor-2 blockade promotes vascular normalization and enhances antitumor immune responses in hepatocellular carcinoma[J].Hepatology,2020,71(4):1247-1261.
[47]MOTZER R J,POWLES T,ATKINS M B,et al.IMmotion151:a randomized phase iii study of atezolizumab plus bevacizumab vs sunitinib in untreated metastatic renal cell carcinoma(mRCC)[J].J Clin Oncol,36(6_suppl):578.
[48]ANDREAS P,DOMINIK W,AXEL H,et al.Synergies of targeting tumor angiogenesis and immune checkpoints in non-small cell lung cancer and renal cell cancer:from basic concepts to clinical reality[J].Int J Mol Sci,2017,18(11):2291.
[49]FUKUMURA D,KLOEPPER J,AMOOZGAR A,et al.Enhancing cancer immunotherapy using antiangiogenics:opportunities and challenges[J].Nat Rev Clin Oncol,2018,15(5):325-340.
[50]CHEN D,MELLMAN I.Oncology meets immunology:the cancer-immunity cycle[J].Immunity,2013,39(1):1-10.
[51]LIN Y Y,TAN C T,CHEN C W,et al.Immunomodulatory effects of current targeted therapies on hepatocellular carcinoma:implication for the future of immunotherapy[J].Semin Liver Dis,2018,38(4):379.
[52]AYARU L,PEREIRA S P,ALISA A,et al.Unmasking of alpha-fetoprotein-specific CD4(+)T cell responses in hepatocellular carcinoma patients undergoing embolization[J].J Immunol,2007,178(3):1914-1922.
[53]XU J,ZHANG Y,JIA R,et al.Anti-PD-1 Antibody SHR-1210 Combined with Apatinib for Advanced Hepatocellular Carcinoma,Gastric,or Esophagogastric Junction Cancer:An Open-label,Dose Escalation and Expansion Study[J].Clin Cancer Res,2019,25(2):515-523.
[54]KASEB A O,VENCE L,BLANDO J,et al.Immunologic Correlates of Pathologic Complete Response to Preoperative Immunotherapy in Hepatocellular Carcinoma[J].Cancer Immunol Res,2019,7(9):1390-1395.
来源:人卫知识数字服务体系






 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.